Pour assurer l’oxygénation cellulaire, le transport (DO2) et la consommation d’oxygène (VO2) doivent être en harmonie. La demande métabolique est le principal déterminant du débit cardiaque, qui est distribué aux organes de manière inhomogène selon leurs fonctions et leurs besoins particuliers. Les mesures que l’on pratique en clinique n’apprécient en général que la consommation globale d’oxygène. Le DO2 est réglé par la ventilation, le débit cardiaque, le contenu en Hb et sa distribution périphérique; il se calcule de la manière suivante:
DO2 = CaO2 • DC
où DC: débit cardiaque
CaO2: contenu artériel en oxygène
CaO2 = [(1.34 • Hb) • SaO2] + (0.0031• PaO2)
Le terme [(1.34 • Hb) • SaO2] représente la quantité d’O2 transportée par l’hémoglobine en mL/min; l’Hb fixe 1.34 à 1.39 mL O2 par gm selon le type d’Hb. Le facteur (0.0031 • PaO2) est la fraction d’oxygène dissoute dans le sang; elle reste une valeur négligeable dans les conditions normales et n’est pas prise en compte dans le transport global, sauf lorsque la FiO2 est élevée :
DO2 = [(1.34 • Hb) • SaO2] • DC
valeur normale: 10 mL/kg/min ou 500 mL/min/m2
La consommation d’O2 est la différence entre le débit artériel et le débit veineux en oxygène:
VO2 = (CaO2 - CvO2) • DC où CvO2 : contenu en O2 du sang veineux mêlé
Donc:
VO2 = (1.34 • Hb) • (SaO2 - SvO2) • DC
valeur normale: 3.5 mL/kg/min ou 250 mL/min
valeur normale SvO2: 70%
On peut tirer de cette équation l’extraction périphérique d’oxygène (EO2):
EO2 = VO2 / DO2
EO2 = (CaO2 - CvO2) / CaO2 = (SaO2 - SvO2) / SaO2
valeur normale: 25 - 30 %
La VO2 mesurée par la méthode de Fick est moins précise que sa mesure par calorimétrie indirecte (méthode des échanges gazeux). De plus, elle ignore la consommation d'oxygène pulmonaire ; celle-ci ne représente que 1-2% de la VO2 totale de l'organisme chez le sujet sain avec des poumons normaux, mais elle s'élève jusqu'à 10% en cas de pneumonie ou de SDRA. Normalement, la VO2 est indépendante du transport pour deux raisons :
- Le DO2 est en excès par rapport à la VO2 ;
- L'extraction d'oxygène augmente parallèlement à la demande comme le démontre la baisse progressive de la saturation veineuse centrale (SvO2).
Il arrive que cette situation soit dépassée: si le transport d'O2 chute en-dessous d'un certain seuil (DO2 critique), l'extraction ne peut plus augmenter proportionnellement à la demande, et la consommation d'O2 devient dépendante de son transport (Figure 6.28). Chez le sujet normal, la valeur de ce seuil se situe entre 9 et 10 mL/min/kg ; il est abaissé à 8.2 mL/min/kg en anesthésie générale [12].
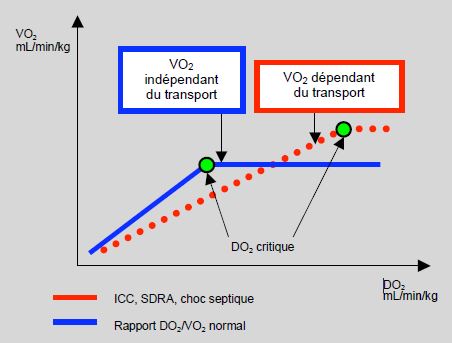
Figure 6.28 : Rapport entre la consommation et le transport d'O2 chez le sujet normal. La courbe bleue représente le sujet normal. La courbe en pointillé rouge illustre la modification induite par une sepsis: le couplage du transport et de la consommation d’oxygène s’étend sur une plus grande plage de valeurs.
DO2 = CaO2 • DC où : CaO2 contenu artériel en oxygène, DC débit cardiaque
CaO2 = (1.39 • Hb • sat O2) + (0.0031 • PaO2)
VO2 = DC • (CaO2 - CvO2)
SvO2 = 1 - VO2 / DO2
Valeurs normales: VO2: 6-7 mL/min/kg ou 200-250 mL/min. DO2: > 10 mL/min/kg ou 800-1000 mL/min. CaO2: 20 vol%. CvO2: 15 vol%. SvO2: > 65 %. ERO2: extraction périphérique d'oxygène: 25-35%.
L'extraction d'O2 (EO2) maximale est de 60%, ce qui se traduit par des valeurs de SvO2 très basses (< 50%). Au-delà de cette capacité d'extraction, la VO2 diminue, le métabolisme devient partiellement anaérobe et le taux de lactate dépasse 1.5 mmol/L [2]. Dans de nombreuses situations pathologiques, la VO2 reste dépendante du transport d'O2 sur une vaste échelle de valeurs, parce que l'extraction d'oxygène reste basse (EO2 < 35%) et que la DO2 critique est plus élevée que la norme (15-20 mL/min/kg). C'est le cas notamment dans le SDRA, le choc septique et le choc hypovolémique. Les patients qui se trouvent sur cette partie de la courbe ont un pronostic vital réservé [6]. C’est sur cette notion que se fonde le concept de thérapie « supramaximale » dans la prise en charge des malades de soins intensifs, visant à maintenir un débit cardiaque supérieur à 4 L/min/m2 afin d’éviter la survenue de défaillances multi-organiques [13]. Cependant, le seuil critique du DO2 est difficile à déterminer chez l’homme, d’autant plus que la consommation d’oxygène ne reste pas constante, même chez un individu sédaté ou endormi [8]. La pertinence pronostique de la dépendance DO2/VO2 reste débattue, et les thérapies supramaximales n'ont pas eu d'impact sur les complications ni sur la mortalité parce qu'elles visaient des valeurs excessives [11]. La morbidité postopératoire peut être réduite en maintenant le DO2 périopératoire à sa valeur préopératoire propre à chaque patient, mais ceci n'est pas lié à la stratégie adoptée [1,9]. En anesthésie cardiaque, le maintien d'une SvO2 > 70% permet de diminuer la morbidité et de raccourcir le séjour en soins intensifs [10]. Deux méta-analyses englobant chacune une trentaine d'études aboutissent à des résultats partiellement contradictoires. L'une a montré que l'augmentation du débit cardiaque avec du volume et des agents vasoactifs diminue l'incidence d'insuffisance rénale et respiratoire ou celle d'infections de plaie, mais qu'elle est sans effet sur la mortalité ou le devenir à long terme [4]. L'autre arrive à la conclusion que le maintien ciblé du DO2 à sa valeur physiologique diminue la mortalité (OR 0.67) et les dysfonctions organiques (OR 0.62) [5]. L'idée d'un DO2 stabilisé en périopératoire avec des perfusions, des inotropes et si nécessaire des transfusions est certainement une conception rationnelle de la prise en charge des cas à risque élevé dans la mesure où elle assure une perfusion tissulaire satisfaisante, à la condition de se référer aux besoins propres de chaque malade et de veiller à réduire l'interventionisme au minimum requis par la situation (dosage minimal de cathécholamines, seul de transfusion restrictif, administration liquidienne basée sur la réponse au volume).
La SvO2 est une mesure clinique représentative de l’oxygénation tissulaire. Elle évalue l’adéquation du transport d’oxygène par rapport aux besoins de l’organisme. Sa valeur normale est ≥ 70%, ce qui correspond à une PvO2 de 40 mmHg environ. Les facteurs qui interfèrent avec l’affinité de l’hémoglobine pour l’oxygène (pH, température, 2,3-DPG, etc) agissent également au niveau veineux et modifient la PvO2 sans affecter la SvO2 de manière identique. D’après les équations ci-dessus, on peut déduire que:
SvO2 = SaO2 - VO2 / (DC • 1.34 • Hb)
valeur normale: ≥ 65 %
Cette formule démontre que la SvO2 n’est pas une mesure univoque; sa baisse peut résulter de quatre facteurs différents:
- L’hypoxémie;
- L’élévation de la VO2;
- La baisse du débit cardiaque;
- L’anémie.
Plusieurs conditions élèvent la SvO2 : la baisse de la VO2, la sepsis (défaut d’extraction périphérique), les fistules artério-veineuses, les shunts gauche-droit (cirrhose hépatique, CIV), l’hypothermie et les intoxications (cyanure, CO). En l’absence d’anémie, d’hypoxémie et de modification de la VO2, la SvO2 évolue en symétrie avec le débit cardiaque. Après chirurgie cardiaque, les patients qui arrivent aux soins intensifs avec une SvO2 < 60% ont davantage de complications cardiovasculaires et une mortalité 5 fois plus élevée à 30 jours que ceux qui présentent une SvO2 > 60% [7].
Pour simplifier l’équipement, on peut remplacer la mesure la SvO2 dans l’artère pulmonaire par la mesure de la saturation veineuse centrale (mixed venous SO2, ou SvcO2) en échantillonnant le sang dans l’OD par un simple cathéter de PVC. Bien que moins fiable, cette mesure reste bien corrélée avec l’adéquation du DC [3,14]. Le sang de l’OD n’est pas entièrement mélangé, et la mesure peut être influencée par son voisinage avec la veine cave inférieure (SO2 élevée) ou le sinus coronaire (SO2 basse). La SvcO2 est en moyenne 5% plus élevée que la SvO2.
| Transport (DO2) et consommation (VO2) d’oxygène |
|
DO2 = CaO2 • DC où : CaO2 (contenu artériel en O2) = [(1.34 • Hb) • SaO2] + (0.0031• PaO2)
(norme : 1'000 mL/min)
VO2 = (CaO2 - CvO2) • DC = (1.34 • Hb) • (SaO2 - SvO2) • DC (norme : 250 mL/min)
Extraction d’O2 = VO2 / DO2 = (CaO2 - CvO2) / CaO2 = (SaO2 - SvO2) / SaO2 (norme : 25-30%)
SvO2 = SaO2 - VO2 / (DC • 1.34 • Hb) (norme : ≥ 65 %)
En clinique, une SvO2 < 60% traduit un déséquilibre dans le rapport DO2/VO2. La gestion des inotropes, des perfusions et des transfusions visant au maintien du DO2 est bénéfique à la condition de se référer aux besoins propres de chaque malade et de veiller à réduire l'interventionisme au minimum requis par la situation.
|
© CHASSOT PG Août 2010, dernière mise à jour Août 2017
Références
- ACKLAND GL, IQBAL S, PAREDES LG, et al. Individualised oxygen delivery targeted haemodynamic therapy in high-risk surgical patients: a multicentre, randomised, double-blind, controlled, mechanistic trial. Lancet Respir Med 2015; 3:33-41
- DANTZKER DR, FORESMAN B, GUTTIEREZ G. Oxygen supply and utilization relationships. Am Rev Resp Dis 1991; 143:675-9
- GORE JM, SLOAN K. Use of contiuous monitoring of mixed venous saturation in the coronary care unit. Chest 1984; 86:757-61
- GROCOTT MP, DUSHIANTHAN A, HAMILTON MA, et al. Perioperative increase in global blood flow to explicit defined goals and outcomes after surgery: a Cochrane systematic review. Br J Anaesth 2013; 111:435-48
- GURGEL ST, DO NASCIMENTO P. Maintaining tissue perfusion in high-risk surgical patients: a systematic review of randomized trials. Anesth Analg 2011; 112:1384-91
- GUTIERREZ G, POHIL RJ. Oxygen consumption is linearly related to oxygen supply in critically ill patients. J Crit Care 1986; 1:45-53
- HOLM J, HAKANSON E, VANKY F, et al. Mixed venous oxygen saturation predicts short- and long-term outcome after coronary artery bypass grafting surgery: a retrospective cohort analysis. Br J Anaesth 2011; 107:344-50
- MAHUTTE CK, JAFFE MB, SASSE SA, et al. Relationship of thermodilution cardiac output to metabolic measurements and mixed venous oxygen saturation. Chest 1993; 104:1236-42
- MOLNAR Z, SZABO Z, NEMETH M. Multimodal individualized concept of hemodynamic monitoring. Curr Opin Anesthesiol 2017; 30:171-7
- PÖLÖNEN P, RUOKONEN E, HIPPELÄINNEN M, et al. A prospective randomized study of goal-oriented hemodynamic therapy in cardiac surgical patients. Anesth Analg 2000; 90:1052-9
- RONCO JJ, PHANG PT, CUNNINGHAM KF, et al. No difference in calculated oxygen kinetics after non-vasodilating interventions between nonsurvivors and survivors of ARDS. Am Rev Respir Dis 1991; 143:A83
- SHIBUTANI T, KOMATSU T, KUBAL K, et al. Critical level of oxygen delivery in anesthetized man. Crit Care Med 1983; 11:640-3
- SHOEMAKER WC, APPEL PL, KRAM HB. Role of oxygen debt in the development of organ failure, sepsis and death in high risk surgical patient. Chest 1992; 102:208-15
- THYS DM. COHEN E, EISENKRAFT JB. Mixed venous oxygen saturation during thoracic anesthesia. Anesthesiology 1988; 69:1005-9
