Bien qu'il soit tenté de considérer ce temps comme une période de repos pour lui, l'anesthésiste a une série de contrôles à effectuer au démarrage de la CEC (Tableau 7.5) et en cours de pompe (Tableau 7.6).
D'autre part, il doit continuer à assurer le sommeil, l'analgésie et la myorelaxation du patient dans une situation où les critères habituels sont perdus (fréquence cardiaque et respiratoire, pression artérielle, PetCO2, etc) [2]. De plus, la CEC introduit d'importantes modifications pharmacocinétiques et pharmacodynamiques. Pour être rapidement efficaces en pompe, les médicaments doivent être administrés dans le circuit veineux de la CEC, ou éventuellement par la voie veineuse centrale, mais jamais par une voie veineuse périphérique où la circulation est très ralentie, notamment en hypothermie. Les perfusions continues restent branchées sur la voie centrale.
La CEC peut débuter lorsque l'ACT a dépassé 400 secondes. Avec des circuits pré-héparinés et une mini-CEC, la valeur recherchée est plus basse: 300-350 secondes [1]. Ces valeurs s'obtiennent par l'administration d'héparine intraveineuse (par la voie centrale) ou intra-auriculaire à raison de 300-400 UI/kg ou de 200-250 UI/kg, respectivement. Pendant l'insertion de la canule artérielle dans l'aorte ascendante, l'anesthésiste abaisse momentanément la pression artérielle (PAM 50 mmHg) pour éviter toute déchirure de l'aorte. A cet effet, on peut utiliser un dilatateur artériel en bolus (phentolamine 1 mg, nicardipine 0.3-1.0 mg, nitroglycérine 50-100 mcg). Une fois la canule en place, la pression aortique doit être pulsatile dans la voie artérielle de la CEC et identique à celle du cathéter artériel. Le chirurgien procède ensuite à la mise en place de la canule de cardioplégie dans la racine de l'aorte. Enfin, une ou deux canules veineuses sont introduites dans l'oreillette droite pour drainer le sang vers la CEC (Figure 7.32). Leur bon positionnement est vérifié à l'ETO.
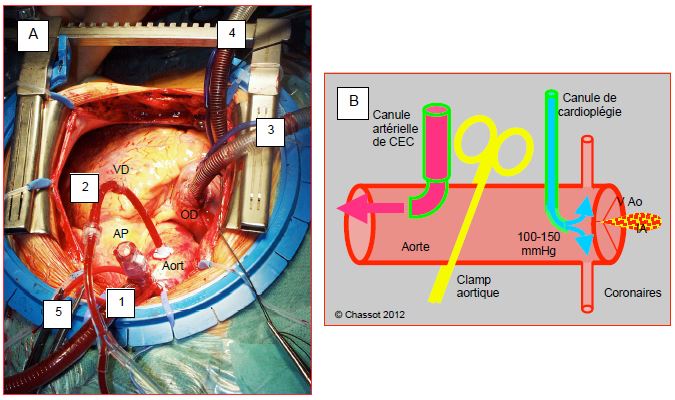
Figure 7.32 : Canulations de CEC. A : canulations dans le champ opératoire vu par l’anesthésiste. 1: canule artérielle dans l'aorte ascendante. 2: canule de cardioplégie. 3: canule de VCS. 4: canule de VCI. 5: fixation de la canule aortique. B : représentation du clampage et de la ligne de cardioplégie; en cas d’insuffisance aortique (IA), la solution de cardioplégie fuit dans le VG et le dilate puisqu’il n’éjecte plus.
Cette dernière manoeuvre est souvent mal tolérée hémodynamiquement par le patient: hypotension, baisse brutale du retour veineux, tachy-arythmies sus-jonctionnelles. Pour rétablir la volémie, le plus simple et le plus efficace est de perfuser des aliquots de 100 mL de la solution d'amorçage par la canule aortique. Les arythmies cessent dès le départ en pompe et la cardioplégie.
Pour démarrer la CEC, le perfusionniste commence par ouvrir progressivement la canule veineuse afin de drainer le sang de l'OD, puis il augmente le débit de la pompe artérielle jusqu'au débit théorique du malade (2.4 L/min/m2). Ce débit doit être atteint en 2-3 minutes afin d'éviter de perfuser les organes avec un sang très dilué par le liquidie d'amorçage, ce qui provoque une hypotension et entraîne un risque ischémique momentané [3]. A ce moment, tout le sang est dérivé dans la machine, qui assure le débit artériel à elle seule. Dès que le plein débit est annoncé par le perfusionniste, l'anesthésiste interrompt la ventilation mécanique. Rien dans la littérature ne permet de recommander une quelconque forme de ventilation autre qu'un flux passif de mélange O2/air (1 L/min, FiO2 0.3-0.5) sous une pression < 5 cm H2O [6,9].
Le début de la CEC est le moment où la vigilance doit être maximale, car c'est la période où les incidents sont les plus fréquents et les plus graves: défauts de matériel, erreur de montage, déconnexion, malposition de canules, "air-lock", hypotension, hypoxémie, dissection de l'aorte, etc. En CEC, les causes d'accidents les plus graves sont l'hypotension artérielle, l'embolie gazeuse et le dysfonctionnement de l'oxygénateur. Elles sont suivies par les déconnexions et les inadvertances dans les clampages [8]. La présence d'air dans la canule artérielle ou dans la canule de cardioplégie est une menace d'embolie cérébrale catastrophique entraînant un AVC massif ou le décès. L'air provient le plus souvent d'une inattention au niveau du réservoir veineux ou d'une inversion entre les circuits veineux et artériel.
Une attention particulière est portée à la couleur des canules veineuses (sang rouge foncé) et artérielle (sang rouge vif). Un sang veineux très foncé ("noir") signe une désaturation veineuse centrale et un bas débit; une désaturation artérielle est caractéristique d'un problème d'oxygénateur. Des saturomètres placés sur ces circuits permettent d'objectiver et de quantifier les observations visuelles (schéma de la CEC: voir Figure 7.3). La saturométrie artérielle du circuit de CEC ne surveille que la performance de l'oxygénateur, non celle du patient; cette dernière est évaluée par la SpO2 du moniteur d'anesthésie, pour autant que le flux artériel soit suffisamment pulsatile. Le renseignement le plus important est apporté par la SvO2 située sur le circuit veineux de retour de la CEC. Si les veines caves ne sont pas correctement drainées, une stase s'installe très rapidement : hépatomégalie, oedème de la face, œdème conjonctival.
Une hypotension passagère est habituelle en début de pompe à cause de l'hémodilution, qui abaisse soudainement la viscosité sanguine et la pression colloïdo-osmotique. Lorsqu'elle était présente dans la solution d'amorçage, l'aprotinine pouvait déclencher une réaction anaphylactique. La pression se rétablit lorsque l'hypothermie augmente la viscosité et provoque une stimulation sympathique. Une hypotension sévère (PAM < 40 mmHg) doit faire rechercher immédiatement un incident grave [10].
- Dissection de l'aorte: disparition de l'onde de pression sur le cathéter artériel alors que la pression est élevée sur la canule artérielle de CEC, et faible retour veineux vers la machine; l'aorte ascendante se boursouffle et devient violacée. Images de dissection à l'ETO.
- Shunt resté ouvert entre la ligne artérielle et la ligne veineuse.
- Evacuation du filtre artériel resté ouvert à trop haut débit.
- Obstacle persistant de la ligne artérielle.
- Asservissement inadéquat du débit de la pompe maîtresse.
Comme le patient est encore normotherme et que son coeur n'est pas arrêté, le traitement d'urgence est un retour en charge immédiat et un arrêt de la CEC.
La dilution brusque des substances en circulation et la stimulation sympathique de l'hypothermie peuvent réveiller malade [5]. Comme le débit pulmonaire devient minime, seuls les médicaments intraveineux administrés dans la CEC sont efficaces. Selon le type de canulation, les substances introduites par la voie veineuse centrale peuvent mettre jusqu'à 5 minutes pour atteindre leur objectif. L'halogéné est vaporisé dans le circuit de l'oxygénateur de CEC.
Pour l'anesthésiste, le passage en CEC s'accompagne d'un certain nombre de manoeuvres et de contrôles (Tableau 7.5) [2].
- Arrêt de la ventilation mécanique, remplacée par un débit continu d'O2/air de 1 L/min (Fi O2 0.3-0.5); pas de N2O [9]. Ceci a lieu dès que le perfusionniste annonce qu'il est à plein débit; si l'opération le requiert, il commence à refroidir. La ventilation n'est pas interrompue en CEC partielle, ni si un problème empêche de tenir le débit sur la pompe.
- Retrait du cathéter de Swan-Ganz de 5-10 cm pour éviter qu'il ne perfore le vaisseau pulmonaire lorsque les poumons collabent et lorsqu'il se rigidifie avec l'hypothermie.
- Arrêt des sons et des alarmes sur le moniteur; réglages des alarmes sur un "programme CEC".
- Maintien de l'anesthésie par un halogéné (1-1.5 MAC) sur l'oxygénateur de CEC ou un agent intraveineux en bolus (midazolam 5-10 mg) ou en perfusion (propofol 5 mg/kg/heure). L’administration médicamenteuse dans le circuit de CEC est plus précise que par la voie centrale; ne pas utiliser les voies veineuses périphériques dont le débit est aléatoire. Un halogéné est un choix préférable lors de revascularisation coronarienne à cause de la protection ischémique offerte par le préconditionnement (voir Protection myocardique).
- Arrêt des perfusions en cours, sauf celle de propofol si c'est l’agent d'anesthésie choisi.
- Curarisation en cas de frissons (hypothermie), d’ouverture des cavités gauches, d’arrêt circulatoire ou de chute de la SvO2 < 60%.
- On considère en général que le débit de pompe normal est de 2.4 L/min/m2 à 35-37°C (70 mL/kg/min) et de 1.8 L/min/m2 à 28°C [11]. Le flux sanguin cérébral est maintenu constant sur une plage de débit de 1.0 à 2.4 L/min/m2, alors que le flux dans les viscères abdominaux baisse dès que le débit est inférieur à 2.0 L/min/m2 [4].
- Hémodynamique: on maintient la PAM à environ 50-60 mmHg. En présence d'athéromatose vasculaire, de diabète, d'hypertension artérielle, d’insuffisance rénale, de sténose carotidienne, d'anamnèse neurologique et d'un âge avancé (> 70 ans), il est préférable de maintenir la PAM à ≥ 70 mmHg [11].
- Cardioplégie: En cas d’insuffisance aortique, même minime, contrôler la taille du VG (ETO) pendant l’administration de la cardioplégie et veiller à l’absence de dilatation ventriculaire. Surveiller ensuite l’adéquation de la cardioplégie par le silence électrique sur l’ECG.
Le débit et la pression artérielle recommandés en CEC sont fondés sur des bases empiriques. La pression moyenne minimale tolérable est idéalement définie par le seuil inférieur de l'autorégulation cérébrale, mais celui-ci varie de 40 à 80 mmHg selon les individus [11]. On peut s'en faire une idée en mesurant la PAM en-dessous de laquelle la saturation cérébrale en O2 (ScO2) devient pression-dépendante (moyenne 66 mmHg) [7]. Lorsque cela est nécessaire, la PAM est relevée par un vasopresseur (phényléphrine, noradrénaline) ou abaissée par un vasodilatateur (phentolamine, nicardipine, nitroglycérine, augmentation momentanée de la Fi isoflurane à 2-5%). On n'administre pas de vasoconstricteur en cas d'insuffisance aortique avant le clampage aortique à cause du risque de dilatation du VG.
Mais la pression artérielle n'est pas l'unique variable d'ajustement en pompe. Elle est l'un des trois éléments qui assurent un apport d'O2 adéquat aux organes:
- Pression artérielle;
- Débit de pompe;
- Hématocrite.
Il est capital de s'assurer que le débit de pompe soit normal avant de modifier les résistances artérielles, car un vasoconstricteur n'est pas la bonne solution si le débit de pompe est insatisfaisant. Pour ce faire, on peut aisément calculer les résistances artérielles systlémiques (RAS) à partir de la formule des résistances artérielles (RAS = 80 (PAM – POD)/DC), puisque le DC est le débit de pompe (DP affiché sur la machine) et la POD est considérée comme nulle parce que vidangée par gravité dans le réservoir veineux de la CEC. On obtient alors: RAS = 80 • (PAM / DP) dynes s cm-5. Utiliser un vasoconstricteur ou un vasodilatateur n'a de sens que si les RAS sont anormales. Si la SvO2 est abaissée à < 60%, il s'agit plutôt d'améliorer le débit de pompe et/ou d'augmenter l'hématocrite.
| Démarrage de la CEC |
|
Démarrage dès que l’ACT est > 400 sec
Arrêt de la ventilation et des perfusions lorsque le plein débit est atteint
Maintien de l’anesthésie par un agent intraveineux (par voie veineuse centrale ou dans le circuit de CEC) ou par un halogéné (sur l’oxygénateur)
Hypotension et risque de réveil/décuraristion sur hémodilution par le liquide d’amorçage
Surveillance du retour veineux (canules OD et/ou veines caves) et de la canule artérielle (risque de dissection aortique)
Le sommeil est maintenu par l’administration continue d’un halogéné (1-1.5 MAC), une perfusion de propofol (3-5 mg/kg/heure) ou des bolus/perfusion de midazolam (5-15 mg). La curarisation est recommandée en cas de frissons, d’ouverture des cavités gauches, d’arrêt circulatoire ou de chute de la SvO2 < 60%.
La PAM est maintenue à 50-60 mmHg; une valeur de 70-80 mmHg est préférable en cas de diabète, d'hypertension artérielle, d'artériosclérose, d’insuffisance rénale, de sténose carotidienne, d'anamnèse neurologique et d'un âge avancé.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- ALDEA GS, DOURSOUNIAN M, O'GARA P, et al. Heparin-bounded circuits with a reduced anticoagulation protocol in primary CABG: a prospective, randomized study. Ann Thorac Surg 1996; 62:410-7
- BARRY AE, CHANEY MA, LONDON MJ. Anesthetic management during cardiopulmonary bypass: a systematic review. Anesth Analg 2015; 120:749-69
- BAUFRETON C, MOREAU X, CORBEAU JJ, et al. Déroulement de la CEC standard et avec les nouveaux dispositifs consommables. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris, Arnette Groupe Liaison SA, 2004, pp 113-45
- BOSTON US, SLATER JM, ORSZULAK TA, et al. Hierarchy of regional oxygen delivery during cardiopulmonary bypass. Ann Thorac Surg 2001; 71:260-4
- BUYLAERT W, HERREGODS L, MORTIER L, et al. Cardiopulmonary bypass and the pharmacokinetics of drugs. Clin Pharmacokinet 1989; 17:10-5
- GARCIA-DELGADO M, NAVARETTE-SÀNCHEZ I, COLMENERO M. Preventing and managing perioperative pulmonary complications following cardiac surgery. Curr Opin Anesthesiol 2014; 27:146-52
- JOSHI B, ONO M, BROWN C, et al. Predicting the limits of cerebral autoregulation during cardioplumonary bypass. Anesth Analg 2012; 114:503-10
- KURUSZ M, WHEELDON DR. Risk containment during cardiopulmonary bypass. Semin Thorac Cardiovasc Surg 1990; 2:400-9
- LELLOUCHE F, DELORME M, BUSSIÈRES J, OUATTARA A. Perioperative ventilatory strategies in cardiac surgery. Best Pract Res Clin Anaesthesiol 2015; 29:381-95
- MEJAK BL, STAMMERS A, RAUCH E, et al. A retrospective study on perfusion incidents and safety devices. Perfusion 2000; 15:51-9
- MURPHY GS, HESSEL EA, GROOM RC. Optimal perfusion during cardiopulmonary bypass: an evidence-based approach. Anesth Analg 2009; 108:1394-417


