Le perfectionnement des techniques de valvuloplasties et de prothèses implantables a permis plus d’agressivité dans l’indication opératoire, y compris chez le malade âgé ou en état avancé. Bien que toute IM sévère ou symptomatique soit une indication opératoire, la pertinence de l'intervention est déterminée par le rapport entre le risque encouru et le bénéfice attendu. L'idéal est de pouvoir corriger l'IM avant que la situation ne se détériore, en réalisant une valvuloplastie dans un centre qui en a une assez vaste expérience pour avoir une mortalité opératoire ≤ 1% et un taux de reprise < 10% à 10 ans [6].
Plastie valvulaire mitrale (PVM)
Si les conditions anatomiques le permettent (prolapsus sur un seul feuillet, feuillets valvulaires souples, longs et peu déformés, appareil sous-valvulaire compétent, absence de calcifications), on procède à une valvuloplastie avec annuloplastie plutôt qu'à un remplacement d'emblée par une valve prothétique; cela est possible dans 50% à 90% des cas, toutes pathologies confondues (voir Plastie mitrale) [3]. Bien que techniquement plus exigeante, la plastie est préférable pour plusieurs raisons [18,19].
- La préservation de l’appareil sous-valvulaire maintient la géométrie du VG et assure une meilleure fonction ventriculaire gauche postopératoire;
- La mortalité est plus basse (< 1% contre 2-4%);
- Les risques thrombo-emboliques et infectieux sont minimes;
- Les risques de détérioration structurelle sont quasi inexistants ;
- L'anticoagulation n'est pas requise à long-terme, mais seulement pendant les 3 premiers mois (délai nécessaire à l'endothélialisation de l'anneau prothétique); seule l'aspirine (75-250 mg/j) est prescrite à vie;
- Chez l’enfant et l’adolescent, la valve peut croître avec la taille du patient.
Le prolapsus et la rupture de cordage des lésions fibro-élastiques sont en général aisées à réparer, particulièrement sur le feuillet postérieur, mais la redondance des tissus dans la maladie de Barlow rend la plastie plus délicate. Les lésions rhumatismales et les calcifications réduisent les chances de plastie, même entre des mains expérimentées [32]. Les réparations du feuillet postérieur donnent en général de meilleurs résultats que celles du feuillet antérieur. Si l'OG est normale, si la fonction du VG est bonne et si le patient n'a jamais présenté de FA, l'aspirine (dose de charge 250 mg/j, entretien 75-250 mg/j) peut suffire [32]. Dans les autres cas, on prescrit une anticoagulation pendant 3 mois en visant un INR de 2.0-2.5, suivie par l'aspirine à vie.
Le taux de réopération après plastie pour lésion structurelle est le même qu'après remplacement par une prothèse mécanique; il est de 7-10% à 10 ans, pour un tiers dû à la progression de la maladie de base et pour deux tiers secondaire à des problèmes techniques [11,23]. Cette incidence est inférieure au taux d'attrition d'une bioprothèse. Dans les IM secondaires ischémiques, par contre, le taux de récidive voisine 30% à 2 ans [12]. La mortalité est de < 1% lorsque l'opération a lieu avant que le VG ne dilate, et de 3-6% en cas de dysfonction ventriculaire avancée [10,32].
La valvuloplastie mitrale percutanée est une nouvelle technique non-invasive par cathétérisme consistant à clipper la partie centrale des deux feuillets pour former un double orifice et réduire la surface de régurgitation (plastie selon Alfieri) [5]. Cette technique est réservée premièrement aux malades en mauvais état général dont la mortalité opératoire serait prohibitive. On ne dispose pas encore de résultats à long terme pour juger de la valeur de ces techniques dont la mortalité est faible mais dont le taux de récidive est élevé. Les résultats sont décrits sous Endoprothèses valvulaires.
Remplacement valvulaire mitral (RVM)
Si la valvuloplastie est impossible, une valve prothétique est mise en place. Autant que faire se peut, on conserve une grande partie des feuillets et on évite de réséquer l'appareil sous-valvulaire (Figure 11.41), car le maintien des seuls cordages de 3ème ordre ne suffit pas à empêcher une certaine sphéricisation du VG et une altération de sa fonction systolique à long terme [26]. Lors de maladie rhumatismale, l'appareil sous-valvulaire est raccorni et restrictif et ne peut pas être conservé; dans ce cas, la fonction ventriculaire se détériore progressivement malgré la compétence de la prothèse, à cause de la perte du squelette interne dynamique que représentaient les piliers et les cordages. Epargner le tissu mitral et les cordages peut conduire parfois à une obstrcution dynamique de la CCVG par les restes du feuillet antérieur. Les bioprothèses peuvent obstruer partiellement la CCVG par le montant situé le plus antérieurement.
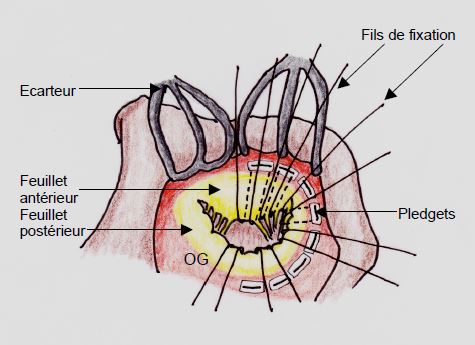
Figure 11.41 : Préservation des feuillets et de l’appareil sous-valvulaire en cours de remplacement valvulaire mitral (RVM). Les fils de fixation de la prothèse sont passés sous les feuillets et les cordages (ou ce qu’il en subsiste après résection) et implantés dans l’anneau mitral sur des pledgets, petits rectangles de téflon assurant la tenue du fil sur le versant auriculaire de l’anneau. A l'écho, ce montage peut parfois donner une certaine mobilité apparente à la prothèse.
Le RVM demande une anticoagulation; celle-ci ne dure que 3 mois avec une bioprothèse, mais est permanente lorsqu'on implante une prothèse mécanique (voir Prothèses valvulaires). Comme le risque thrombo-embolique est plus grand en position mitrale qu'en position aortique, on recherche un INR de 3.0-3.5 indéfiniment [2,24]. Avec les bioprothèses, le risque de dégradation structurelle est plus rapide en position mitrale qu'en position aortique; le taux de réopération à 15 ans est respectivement de 50% et de 29% [14].
Les résultats de la chirurgie du remplacement valvulaire mitral restent assez lourds: la mortalité opératoire est de 2-6% selon l'état des patients [7]. La survie à 10 ans des malades symptomatiques est de 61% (> 85% après plastie) [8]. Elle est de 76% chez les malades opérés lorsqu’ils sont encore aymptomatiques [30]. Pour les lésions post-RAA, la survie est de 70% à 5 ans [27]. Comparativement, la survie à 5 ans sans opération oscille entre 20% et 30% [15]. Le devenir des patients à qui on implante une prothèse pour une IM pure symptomatique est moins bon que celle des malades qui souffrent d’une sténose pure ou d’une maladie mitrale mixte, probablement parce que leur fonction ventriculaire est déjà plus gravement atteinte lorsqu’ils deviennent symptomatiques [20].
Indications opératoires de l'IM primaire
Il est primordial d'opérer le patient souffrant d'une IM sévère avant que ne survienne une détérioration fonctionnelle qui empèche une récupération satisfaisante après l'intervention et qui en triple la mortalité. Avec une mortalité de 90% à 10 ans sans intervention [21], l'opération est quasiment inévitable, mais le problème est de bien choisir le moment auquel intervenir. Ceci est délicat pour plusieurs raisons.
- Le patient reste longtemps asymptomatique;
- La fonction ventriculaire se détériore silencieusement;
- Les indices habituels de la fonction contractile ne sont pas pertinents;
- La fonction peut se détériorer en postopératoire;
- Il est difficile de prédire si la valvuloplastie sera un succès;
- La mortalité opératoire est significative; elle est de 1-2% pour la plastie et de 2-6% pour le remplacement par une prothèse [29]; pour justifier une intervention précoce, la mortalité doit être dans la fourchette inférieure de ces valeurs.
Les recommandations actuelles (classe I et classe IIa) considèrent les éléments suivants comme des indications opératoires face à une IM sévère d'origine organique (IM structurelle primaire) [2,9,24,25,31].
- IM sévère cliniquement symptomatique (stade D).
- IM sévère avec apparition ou présence de dysfonction ventriculaire (diamètre télésystolique du VG > 4.5 cm ou > 2.5 cm/m2, FE < 0.6, PAPsyst > 60 mmHg à l’effort), de FA ou d'hypertension pulmonaire, même asymptomatique (stade C2).
- IM sévère avec détérioration du remodelage au suivi échocardiographique (diamètre de l'OG > 5 cm, diamètre télésystolique du VG > 4.5 cm ou 2.5 cm/m2), même si le patient reste asymptomatique (stade C2)
- IM sévère asymptomatique avec fonction ventriculaire conservée (stade C1), si l'orifice de régurgitation est > 0.4 cm2, si des examens répétés montrent une baisse de fonction ou une dilatation progressive du VG, si la probabilité de réussite d'une plastie est > 90% et si la mortalité opératoire probable est < 1%; ceci est justifié à cause du risque élevé de complications dans les 5 ans [9,28]. A 7 ans, le taux de survie est de 98% après plastie et de 85% avec un traitement médical [16].
- IM modérée ou modérée-à-sévère (stade B) comme intervention concommittante si le patient subit une autre intervention de chirurgie cardiaque, si la probabilité de réussite d'une plastie est élevée et si le risque opératoire n'est pas excessif.
Dans les insuffisances aiguës ou subaiguës, l’opération est indiquée aussi rapidement que possible si l’hypertension veineuse pulmonaire ne peut pas être jugulée par le traitement médical: OAP persistant, dyspnée paroxystique nocturne, bas débit systémique, élévation de la créatinine, PAP systolique > 50 mmHg au repos.
La personne âgée (> 65 ans) récupère beaucoup moins bien de la chirurgie mitrale que de la chirurgie pour sténose aortique, parce que le VG est immédiatement soulagé de la postcharge excessive dans le deuxième cas, alors qu’il échange une surcharge de volume bien tolérée contre une surcharge de pression mal tolérée dans le premier cas. Comme la mortalité opératoire excède 14% chez ces patients, seule une IM sévère avec symptômes de décompensation est justifiable d'une intervention chirurgicale [2,24].
Correction de l'IM secondaire
Alors que le traitement de base de l'IM primaire est la chirurgie reconstructive, celui de l'IM secondaire est dirigé en premier lieu vers l'afffection de base (ischémie coronarienne, défaillance ventriculaire) [6]. Vu sa fréquence, il n'est pas rare de rencontrer une IM secondaire modérée ou plus importante chez un malade souffrant d'ischémie coronarienne ou d'une autre pathologie cardiaque. En salle d'opération, cette découverte pose un problème ardu lorsque l'IM est modérée-à-sévère ou sévère: faut-il corriger la pathologie mitrale simultanément ? Et si oui, par quelle technique ? Comme on n'a jamais démontré de bénéfice sur la mortalité en réalisant une intervention mitrale supplémentaire et que le risque de récidive après plastie (33%) est plus élevé que dans les IM structurelles [1,12], les recommandations actuelles sont assez restrictives (voir IM ischémique) [2,4,13,17,24,25].
- IM secondaire modérée ou modérée-à-sévère: bénéfice incertain, en général pas d'indication opératoire.
- IM secondaire sévère symptomatique (stade D): indication selon la situation.
- Indication de classe IIa si la plastie est aisée, la FE > 30%, le risque opératoire faible et la survie à long terme du malade hautement probable;
- Indication de classe IIa si l'IM se péjore au test d'effort; une réduction de l'IM sous dobutamine signe au contraire une réserve contractile du VG qui incite à une revascularisation seule, sans intervention mitrale d'accompagnement;
- Indication de classe IIa si le patient subit une autre intervention de chirurgie cardiaque en CEC (PAC, RVA, etc).
Une annuloplastie est l'intervention de préférence lorsque la dilatation du VG est encore modeste et que les données échocardiographiques prédisent une bonne probabilité de réussite. Dans le cas contraire, le remplacement par une prothèse présente une survie équivalente et supprime le risque de récidive [1,6,12]. Les indications particulières des IM ischémiques et des IM secondaires à une cardiomyopathie dilatative sont présentées plus loin (voir IM ischémique et IM sur défaillance du VG).
L'IM secondaire n'est pas en soi une indication à une correction en CEC en l'absence d'intervention justifiée pour une autre raison (revascularisation coronarienne, RVA, etc), sauf parfois si l'IM reste sévère et symptomatique (stade D) malgré un traitement causal optimal (traitement médical, PCI, resynchronisation, etc) (indication de classe IIb) [2,6,25]. L'intervention améliore en général la symptomatologie mais ne modifie pas la survie [22]. La plastie percutanée (MitraClip™) est envisageable chez les patients symptomatiques si les critères d'éligibilité échocardiographiques sont remplis, car le risque opératoire est moindre avec une intervention non-invasive qu'avec une opération en CEC (voir Endoprothèses valvulaires).
| Indications opératoires de l’insuffisance mitrale |
|
Indications opératoires pour une IM organique primaire sévère (orifice de régurgitation > 0.4 cm2):
- Patient symptomatique
- Dysfonction ventriculaire (Dts VG > 2.5 cm/m2)
- Fibrillation auriculaire
- Détérioration au suivi échocardiographique d’un patient encore asymptomatique
- Patient asymptomatique si probabilité de réussite de plastie > 90%
Lorsqu’elle est faisable (50-90% des cas), la plastie mitrale (PVM) est toujours préférable au remplacement valvulaire (RVM) parce que :
- La mortalité est plus basse (1-2% versus 4%)
- La fonction du VG est mieux conservée
- L’anticoagulation n’est pas nécessaire > 3 mois (INR 3-3.5 à vie après prothèse mécanique)
- Le risque thrombo-embolique et infectieux est minime
- Le taux de reprise (7-10% à 10 ans) est le même que pour une prothèse mécanique ; il est inférieur au taux d’attrition d’une bioprothèse
Indications opératoires pour une IM fonctionnelle secondaire sévère:
- Echec du traitement médical
- Intervention cardiaque simultanée (pontages aorto-coronariens, chirurgie valvulaire aortique)
- IM sévère symptomatique
- Bonne probabilité de réussite d'une plastie
Problème: mortalité opératoire significative, taux de récidive élevé, absence de bénéfice en terme de survie. Alternative si risque opératoire excessif: plastie mitrale percutanée (MitraClip™).
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- ACKER MA, PARIDES MK, PERRAULT LP, et al. Mitral valve repair versus replacement for severe ischemic mitral regurgitation. N Engl J Med 2014; 370:23-32
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BRAUNBERGER E, DELOCHE A, BERREBI A, et al. Very long-term results (more than 20 years) of valve repair with Carpentier's techniques in non-rheumatic mitral valve insufficiency. Circulation 2001; 104(suppl I):8-11
- CHAN KMJ, PUNJABI PP, FLATHERE M, et al. Coronary artery bypass surgery with or without mitral valve annuloplasty in moderate functional ischemic mitral regurgitation. Circulation 2012; 126:2502-10
- CONDALO J, ACQUATELLA H, RODRIGUEZ L, et al. Percutaneous edge to edge mitral valve repair: 2-year follow-up in the first human case. Catheterization Cardiovasc Interv 2006; 67:323-5
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- EDWARDS FH, PETERSON ED, COOMBS LP, et al. Prediction of operative mortality after valve replacement surgery. J Am Coll Cardiol 2001; 37:885-94
- ENRIQUEZ-SARANO M, SCHAFF HV, ORSZULAK TA, et al. Valve repair improves the outcome of surgery for mitral regurgitation: A multivariate analysis. Circulation 1995; 91:1022-9
- ENRIQUEZ-SARANO M, SUNDT TM. Is early surgery recommended for mitral regurgitation ? Early surgery is recommended for mitral regurgitation. Circulation 2010; 121:804-12
- FOSTER E. Mitral regurugitation due to degenerative mitral-valve disease. N Engl J Med 2010; 363:156-65
- GILLINOV AM, COSGROVE DM, LYTLE BW, et al. Reoperation for failure of mitral valve repair. J Thorac Cardiovasc Surg 1997; 113:467-73
- GOLDSTEIN D, MOSKOWITZ AJ, GELIJNS AC, et al. Two-year outcomes of surgical treatment of severe ischemic mitral regurgitation. N Engl J Med 2016; 374:344-53
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- HAMMERMEISTER KE, SEHTI GK, HENDERSON WG, et al. Outcomes 15 years after valve replacement with a mechanical versus bioprosthetic valve: final report of the Veterans Affairs randomized trial. J Am Coll Cardiol 2000; 36:1152-8
- HORSTKOTTE D, NIEHUES R, STRAUER BE. Pathomorphological aspects, aetiology, and natural history of acquired mitral valve stenosis. Eur Heart J 1991; 12(Suppl):55-60
- KANG DH, KIM MJ, RIM JH, et al. Comparison of early surgery versus conventional treatment in asymptomatic severe mitral regurgitation. Circulation 2009; 119:797-804
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- LAZAM S, VANOVERSCHELDE JL, TRIBOUILLOY C, et al. Twenty-year outcome after mitral valve repair versus replacement for severe degenerative mitral regurgitation: analysis of a large, prospective, multicenter, international registry. Circulation 2017; 135:410-22
- LEE EM, SHAPIRO LM, WELLS FC. Superiority of mitral valve repair in surgery for degenerative mitral regurgitation. Eur Heart J 1997; 18:655-63
- LEE SJK, BAY KS. Mortality risk factors associated with mitral valve replacement: A survival analysis of 10-year survival data. Can J Cardiol 1991; 7:11-9
- LING LH, ENRIQUEZ-SARANO M, SEWARD JB, et al. Clinical outcome of mitral regurgitation due to flail leaflet. N Engl J Med 1996; 335:1417-23
- MICHLER RE, SMITH PK, PARIDES MK, et al. Two-year outcomes of surgical treatment of moderate ischemic mitral regurgitation. N Engl J Med 2016; 374:1932-41
- MOHTI D, ORSZULAK TA, SCHAFF HV, et al. Very long-term survival and durability of mitral valve repair for mitral valve prolapse. Circulation 2001; 104:I1-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- PITARYS CJ, FORMAN MB. PANAYIOTOU H, et al. Long-term effects of excision of the mitral apparatus on global and regional ventricular function in humans. J Am Col Cardiol 1990; 15:557-65
- RANKIN JS, HAMMIL BG, FRERGUSON B, et al. Determinants of operative mortality in valvular heart surgery. J Thorac Cardiovasc Surg 2006; 131:547-57
- ROSENHECK R, RADER F, KLAAR U, et al. Outcome of watchful waiting in asymptomatic severe mitral regurgitation. Circulation 2006; 113:2238-44
- STS – Society of Thoracic Surgeons National Cardiac Surgery Database, 2017. https://www.sts.org/site/defaut/files/documents/ ACSD_ExecutiveSummary2017Harvest4_RevisedReport.pdf
- TRIBOUILLOY C, ENRIQUEZ-SARANO M, SCHAFF HV, et al. Impact of preoperative symptoms on survival after surgical correction of organic mitral regurgitation: Rationale for optimizing surgical indications. Circulation 1999; 99:400-7
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- VERMA S, MESANA TG. Mitral valve repair for mitral valve prolapse. N Engl J Med 2009; 361:2261-9
