D'une manière générale, deux données déterminent le retentissement hémodynamique du clampage de l'aorte.
- Le degré de sténose aortique et de collatéralisation: l'effet du clampage est majeur dans les anévrysmes, parce que le flux était normal jusque-là, alors qu'il est minime dans une sténose qui ne laissait passer qu'un filet de sang. De plus, le développement des collatérales lors de sténose assure un flux distal malgré le clampage.
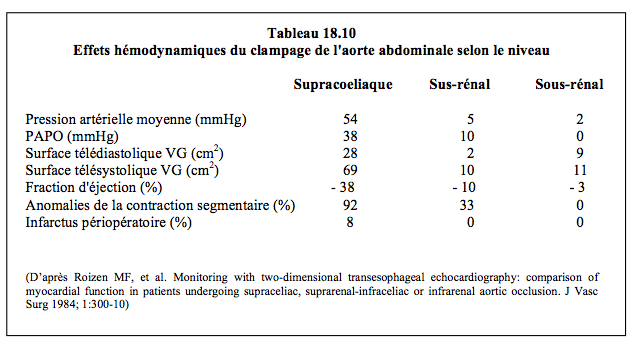
- Le niveau du clampage: plus il est distal, moins le clampage a de retentissement hémodynamique (Tableau 18.10) et moins l'ischémie des organes abdominaux est importante.
Une ischémie médullaire survient de manière apparemment aléatoire dans 0.25% des cas. Parmi les origines possibles, on relève la durée du clampage, son niveau, l’hypotension pendant le clampage, l’embolisation depuis l’aorte, ou l’interruption du flux dans les iliaques internes; mais aucune de ces causes ne s’est révélée déterminante à elle seule [7].
Niveaux de clampage aortique
On peut distinguer schématiquement trois niveaux de clampage (Figure 18.45).
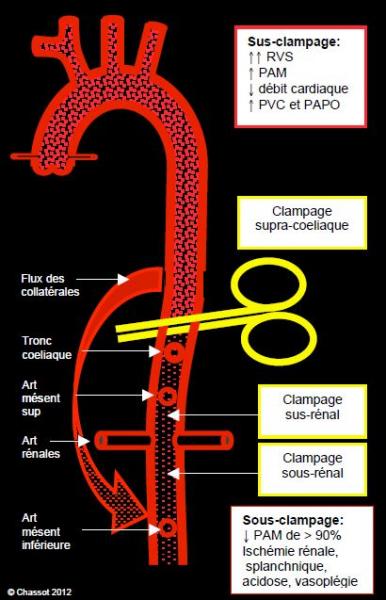
Figure 18.45 : Illustration schématique des différents niveaux de clampage de l'aorte abdominale. Un clampage supracoeliaque coupe la vascularisation du foie, de la rate, du pancréas, des reins et de tout le tube digestif. Un clampage sus-rénal épargne le foie, la rate, le duodénum, l'intestin grêle et le pancréas. Le réseau des collatérales, dont le flux est pression-dépendant, assure un débit variable dans la zone distale au clamp.
- Clampage supra-coeliaque, caractérisé par une ischémie de tout le réseau splanchnique (foie, viscères et reins). Le clamp est positionné au niveau ou au-dessus du diaphragme, ce qui présente un risque d’ischémie médullaire au même titre que la chirurgie de l’aorte descendante basse. On peut utiliser une CEC fémoro-fémorale pour maintenir le débit sanguin dans tout l’hémi-corps inférieur, ou perfuser sélectivement chacun des troncs artériels viscéraux pour éviter l’ischémie digestive (mais non médullaire) pendant le clampage et l'anastomose proximale de la prothèse aortique. Ils sont ensuite réimplantés dans cette dernière (voir Figure 18.42). La mortalité opératoire est directement liée à la durée de l’ischémie viscérale dès que celle-ci dépasse 30 minutes (odds ratio 10.8) [1]. Les complications digestives et l’insuffisance rénale affectent respectivement 34% et 23% des patients.
- Clampage supra-rénal. L’insuffisance rénale postopératoire (incidence 22%) est directement liée à la durée de l’ischémie ; le taux de malades dialysés en postopératoire est de 4-10%; il est directement proportionnel au niveau préopératoire de la créatinine. La mortalité est de 3-11% [1,11].
- Clampage infra-rénal. La mortalité est inférieure à 5% et le taux d’insuffisance rénale postopératoire de 3-5% [10]. Toutefois, le clampage juxta-rénal réduit le flux plasmatique rénal de 50%. Le sacrifice de l'artère mésentérique inférieure entraine 1% de nécrose colique [2,12].
Physiopatholgie du clampage aortique
Le clampage cause une augmentation immédiate de l'impédance à l'éjection ventriculaire gauche. Pour vaincre cette résistance, le VG augmente son volume télédiastolique (phénomène de Frank-Starling) en augmentant sa précharge, et accroît sa contractilité (effet Anrep). De plus, une redistribution du flux coronaire vers le sous-endocarde augmente la perfusion dans les zones les plus sollicitées lorsque la tension de paroi s'élève. L'équilibre hémodynamique va dépendre du degré d'augmentation de la postcharge, des possibilités du VG à augmenter sa force, et du retour veineux effectif qui permet de régler la tension de paroi télédiastolique. L'hypertension d'amont est due à l'effet mécanique du clampage, mais aussi à la décharge sympathique (sécrétion d’adrénaline et de noradrénaline) et à l'activation du système rénine-angiotensine [3,4]. Pendant le clampage de l’aorte abdominale, le flux dans l’aorte thoracique descendante baisse d’environ 30% ; les signes de souffrance digestive (baisse du pHi gastrique) apparaissent lorsque le flux est < 0.8 L/min/m2, alors que la fonction gastro-intestinale est protégée s’il est > 1.2 L/min/m2 [5].
En cas de dysfonction systolique (FE < 0.4), le VG est extrêmement sensible à la postcharge. Son volume systolique baisse lorsque cette dernière augmente ; il dilate sans parvenir à augmenter sa force éjectionnelle. Sa pression de remplissage est élevée à cause de la défaillance ventriculaire; une onde "v" apparaît sur le tracé de la PAPO. Dans ce cas, un vasodilatateur artériel est nécessaire pour maintenir le débit cardiaque. En cas d'ischémie coronarienne, l'augmentation de la tension de paroi en systole (accroissement de postcharge) et en diastole (accroissement de précharge) provoque une dangereuse élévation de la demande en O2 et un risque élevé d'ischémie sous-endocardique. C'est un dérivé nitré qui est alors nécessaire pour baisser la précharge et améliorer le flux coronarien.
Mais l'augmentation des pressions de remplissage peut aussi être due à une redistribution du volume sanguin. L’interruption du flux au-delà du clamp n’alimente plus le réseau veineux ; celui-ci se vide progressivement et la capacitance veineuse des organes diminue. Ceci correspond à un transfert de volume sanguin depuis la circulation splanchnique vers la circulation systémique de la partie supérieure du tronc et des bras, où la précharge augmente et où le débit double [2]. Dans les clampages sous-rénaux, ce phénomène est amorti parce que le lit splanchnique encore perfusé agit comme un réservoir et thésaurise le volume transféré ; la précharge et le débit cardiaque se modifient peu. Lorsque l'occlusion se prolonge, un deuxième phénomène entre en jeu: le lit vasculaire ischémié se vasodilate à cause de l'acidose, le sang y reste stocké, et le retour veineux baisse progressivement. Le ventricule ne dispose plus alors de la précharge nécessaire au développement d'une force contractile adéquate. Un apport de volume devient essentiel, quand bien même les pressions de remplissage ne sont pas basses. La précharge ventriculaire évolue donc en deux temps pendant un clampage de l’aorte abdominale:
- Au début, augmentation lorsque la veine cave se vide progressivement dans l’OD;
- Puis diminution lorsque cette source s’est tarie et que le réseau ischémié s’est vasodilaté (stockage de sang perfusé par les collatérales).
Un vasodilatateur artériel comme le nitroprussiate est susceptible de diminuer la postcharge par baisse des résistances artérielles au-dessus du clamp, mais il n'augmente pas le flux en dessous du clamp, car les vaisseaux y sont déjà maximalement dilatés à cause de l'ischémie. En effet, distalement au clampage, le flux dépend de la pression locale et non du débit cardiaque; il est assuré par la collatéralisation anatomique qui est d'autant plus importante que le clampage est distal, et par les collatérales qui se sont développées en cas d'obstruction aortique chronique. Dans les collatérales, le flux est pression-dépendant. L'utilisation de vasodilatateurs artériels en cours de clampage baisse encore la pression de perfusion résiduelle au-dessous du clamp et compromet davantage la survie tissulaire. Elle n’est donc indiquée qu’en cas de défaillance prouvée du VG (par exemple dilatation ventriculaire à l’échocardiographie) et doit maintenir une PAM d'environ 80 mmHg pour assurer un débit résiduel minimal en-dessous du clamp.
Déclampage de l'aorte
Le déclampage est un moment d'instabilité hémodynamique. La pression artérielle baisse brusquement pour plusieurs raisons [2,6]:
- Baisse soudaine de la postcharge à l'ouverture du clamp;
- Hémorragie chirurgicale par les anastomoses;
- Séquestration de volume dans le lit distal vasodilaté par l'acidose;
- Acidose métabolique systémique (retour veineux de sang acide depuis zones ischémiées); la PetCO2 augmente;
- Mise en circulation de substances vaso-actives (cytokines, TNF, kinines, interleukines, thromboxane, prostaglandines, radicaux libres peroxydants, cascade du complément) qui ont un effet vasodilatateur systémique, vasoconstricteur pulmonaire et cardio-dépresseur [9];
- Endotoxines bactériennes franchissant la barrière intestinale et colique à la faveur de l'ischémie tissulaire [8];
- Hypérémie réactive des territoires ischémiés, maximale à 15 minutes.
Le lit vasculaire qui était au-dessus du clamp répond mieux aux vasoconstricteurs artériels que le lit distal, encore vasoplégique à cause de l'ischémie et de l'acidose, ce qui peut occasionner un phénomène de "vol" dans le territoire d'aval.
| Clampage de l’aorte abdominale |
|
Anévrysme : flux conservé, le clampage augmente fortement la postcharge du VG.
Sténose (syndrome de Leriche): flux très faible, forte collatéralisation; peu d’effet du clampage.
Clampage supra-coeliaque: ischémie du foie, des viscères, des reins et de la moelle; prise en charge comme la chirurgie de l’aorte descendante.
Clampage sus-rénal: ischémie rénale; insuffisance rénale postopératoire dans 22% des cas.
Clampage sous-rénal: risque moindre.
Physiopathologie du clampage aortique:
- ↑ postcharge du VG
- Le VG ↑ sa contractilité par effet Starling (↑ Vtd)
- Après quelques minutes, le retour veineux par la VCI baisse; l’ischémie provoque une vasodilatation et un stockage de sang en dessous du clamp
- Le Vtd du VG doit être maintenu par du remplissage pour pouvoir bénéficier de l’effet Starling
- Si VG dysfonctionnel (FE < 0.5), risque de dilatation aiguë sur ↑ postcharge
Même si la PAM est maintenue, l’augmentation de postcharge représente un stress majeur pour le VG, dont la performance systolique baisse momentanément ( ↓ FE, ↓ vélocité d’éjection, ↓ Vcf, ↑ durée d’éjection). L’importance des effets hémodynamiques est fonction du niveau de clampage.
Les amines à effet béta augmentent la performance du VG, mais augmentent aussi sa VO2.
Les vasodilatateurs artériels baissent la postcharge du VG; mais ils baissent la pression de perfusion coronarienne et diminuent le flux collatéral qui maintient une perfusion minimale en dessous du clamp (PAM recherchée: 80 mmHg).
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- BACK MR, BANDYK M, BRADNER M, et al. Critical analysis of outcome determinants affecting repair of intact aneurysms involving the visceral aorta. Ann Vasc Surg 2005; 19:648-56
- GELMAN S. The pathophysiology of aortic cross-clamping and unclamping. Anesthesiology 1995; 82:1026-60
- GELMAN S, BREDLE WE, BRADLEY WE, et al. Angiotensin and alpha-adrenoreceptor activation play a role in hemodynamic response to aortic crossclamping. Am J Physiol 1990; 259:H68-H73
- GELMAN S, CURTIS SE, BRADLEY WE, et al. Angiotensin and adrenoreceptors role in hemodynamic response to aortic cross-clamping. Am J Physiol 1993; 264:H14-H20
- KOTAKE Y, YAMADA T, NAGATA H, et al. Descending aortic blood flow during cross-clamp indicates postoperative splanchnic perfusion and gastrointestinal function in patients undergoing aortic reconstruction. Br J Anaesth 2012; 108:936-42
- LEVY RS, CLAGNAZ F. Anesthesia for surgery of the abdominal and distal aorta. In: SIMPSON JI, ed. Anesthesia for aortic surgery. Boston, Butterworth-Heinemann 1997, 229-53
- ROSENTHAL D. Spinal cord ischemia after abdominal aortic operation: Is it preventable ? J Vasc Surg 1999; 30:391-9
- ROUMEN RMH, FRIELING JTM, VAN TITS HWT, et al. Endotoxemia after major vascular operations. J Vasc Surg 1993; 18:853-7
- ROYTBLATT L, GELMAN S, HENDERSON T, et al. Humoral factors and hemodynamics during cross-clamping of the thoracic aorta. J Cardiothorac Vasc Anesth 1991; 5:10-4
- TALLGREN M, NIEMI T, PÖYHIÄ R, et al. Acute renal injury and dysfunction following elective abdominal surgery. Eur J Vasc Endovasc Surg 2007; 33:550-5
- WEST CA, NOEL AA, BOWER TC, et al. Factors affecting outcomes of open surgical repair of pararenal aortic aneurysms: A 10-year experience. J Vasc Surg 2006; 43:921-8
- YEUNG KK, GROENEVELD M, LU JJN, et al. Organ protection during aortic cross-clamping. Best Pract Res Clin Anaesthesiol 2016; 30:305-15
