L'ischémie peropératoire est par nature silencieuse. La plupart des épisodes surviennent en l’absence de modifications hémodynamiques, suggérant ainsi qu’ils ont pour origine une insuffisance dans l’apport d’oxygène (bas débit coronarien, spasmes, instabilité de plaques athéromateuses) plutôt qu’un excès de demande métabolique myocardique. Le risque d'une coronaropathie cliniquement instable (angor stade III-IV) est donc beaucoup plus élevé que celui d'un angor stable ou stabilisé (stade I-II). Le diagnostic repose sur des données paracliniques; trois méthodes sont couramment utilisées à cet effet (voir Chapitre 9 Monitorage):
- L'ECG, avec surveillance du segment ST ;
- La cinétique segmentaire du VG à l'ETO ;
- Les biomarqueurs.
Aucune d'entre elles n'a une spécificité ni une sensibilité suffisante pour devenir le critère de référence, qui, par défaut, est attribué à l'ECG. Cependant, dans certaines situations comme la revascularisation coronarienne à cœur battant, l’ETO s’avère plus sensible et plus spécifique que l’ECG. Le Tableau 6.8 compare les sensibilités et spécificités moyennes des techniques de surveillance hémodynamiques.
L’ECG
En général, l'ECG est le mode surveillance le plus spécifique ; il est également très sensible. Il est bon marché et très simple d'utilisation; il fonctionne en permanence et ne nécessite par de compétence très particulière. Il est le plus efficace pour la détection des sous-décalages du segment ST spécifiques des lésions sous-endocardiques, qui caractérisent les malades subissant des interventions de chirurgie générale (voir Figures 6.1 et 6.2). En chirurgie cardiaque, l'ouverture du sternum, les manipulations chirurgicales du cœur, la survenue de troubles de la conduction ou la nécessité d'un entraînement électrosystolique limitent les renseignements fournis par l'analyse du segment ST et expliquent en partie l'incidence élevée d'akinésies segmentaires périopératoires en l'absence de tout signe électrocardiographique. D'autres signes électriques peuvent traduire des épisodes ischémiques: ESV multifocales, tachycardie ventriculaire, fibrillation ventriculaire, blocs de branche intermittents ou permanents.
En chirurgie cardiaque, l’air qui peut se collecter dans les cavités gauches est éjecté dès le déclampage de l’aorte. Cet air à tendance à se drainer dans la coronaire droite (CD) ou dans les pontages aorto-coronariens veineux qui sont implantés à la face antérieure de l'aorte. Il est fréquent de constater alors des sus-décalages du segment ST (en DII si l’embolie est dans la CD), ou des troubles de la conduction (BBD, BAV complet). Ces modifications sont transitoires [1].
L’ETO
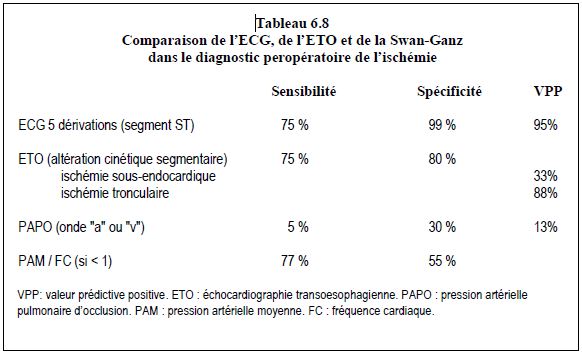
Les trois territoires coronariens des ventricules sont bien identifiables à l’ETO (Figure 6.76).
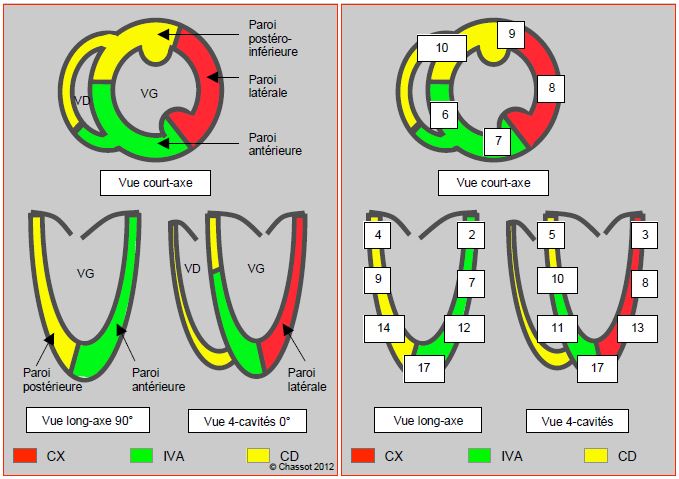
Figure 6.76 : Représentation schématique des différents territoires coronariens vascularisés par chaque tronc artériel dans des coupes échocardiographiques transoesophagiennes habituelles des ventricules. La numérotation commence à la base. Le VG est divisé en trois parties (basale, moyenne, distale) ; la partie apicale est le 17ème segment. Chaque segment est évalué sur une échelle de contractilité de 5 points : 1 = normal, 2 = hypokinésie légère, 3 = hypokinésie sévère, 4 = akinésie, 5 = dyskinésie.
A l’échocardiographie, l’ischémie se présente sous la forme de modifications de la cinétique segmentaire : hypokinésie, akinésie ou dyskinésie d’un ou de plusieurs segments du ventricule (Vidéos) (voir Chapitre 25, Fonction ventriculaire segmentaire).
Vidéo: akinésie antéro-apicale étendue du VG en vue mi-oesophaienne 2-cavités (90°), due à une obstruction de l'IVA.
Vidéo: Akinésie totale de la paroi latérale du VG (vue mi-oesophage 4-cavités 0°) après des pontages aorto-coronariens, due à une thrombose de l'anastome sur l'artère circonflexe.
Vidéo: akinésie antéro-apicale étendue du VG en vue mi-oesophaienne 2-cavités (90°), due à une obstruction de l'IVA.
Vidéo: Akinésie totale de la paroi latérale du VG (vue mi-oesophage 4-cavités 0°) après des pontages aorto-coronariens, due à une thrombose de l'anastome sur l'artère circonflexe.
Chez les patients souffrant de lésions transmurales persistantes, ce qui est le cas des patients subissant des interventions de revascularisation coronarienne, la moitié des incidents ischémiques visibles à l'ETO ne s'accompagne pas de modifications hémodynamiques, et dans 40% des cas il n'y a pas d'altérations électriques du segment ST [18]. La valeur prédictive positive de l’ETO pour l’infarctus postopératoire s’élève jusqu’à 88% en chirurgie cardiaque, alors qu’elle n’est que de 33% pour les accidents ischémiques survenant en chirurgie non-cardiaque où les lésions prédominantes sont sous-endocardiques [6,17]. La place de l’ETO dans le monitorage de l’ischémie demande quelques remarques.
- Bien qu'il ait une bonne sensibilité (80%) pour le diagnostic de l’ischémie segmentaire, l'ETO n'a qu'une faible spécificité pour son monitorage, car les altérations de la cinétique segmentaire (ACS) peuvent être dues à d'autres causes (dysfonction ventriculaire, péricardotomie, blocs de branche, etc).
- L’ETO est sensible à l’ischémie segmentaire caractéristique de lésions tronculaires, mais non à l’ischémie sous-endocardique, raison pour laquelle il a plus d’impact en chirurgie coronarienne qu’en chirurgie non-cardiaque (Figure 6.77).
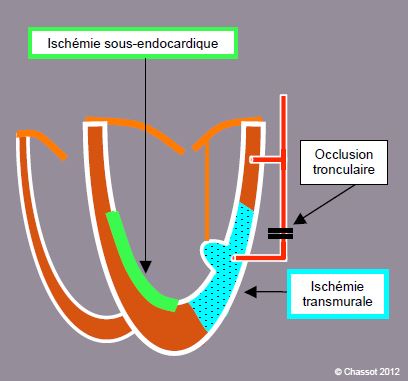
Figure 6.77 : Illustration schématique du rapport entre l'ischémie myocardique et l'image échocardiographique. L’occlusion d’un tronc coronarien se traduit par une ischémie transmurale (surface pointillée) qui provoque une altération de la cinétique segmentaire visible à l’échocardiographie. Les lésions distales conduisent à une ischémie diffuse sous-endocardique (en vert), qui ne se traduit pas par des altérations cinétiques visibles aux ultrasons. L'implication d'un pilier dans le territoire ischémie peut provoquer une insuffisance mitrale.
- Il n’y a surveillance de l’ischémie que dans la mesure où l’anesthésiste observe l’écran de l’appareil, ce qui ne peut pas être continu.
- La surveillance des ACS est délicate et demande une formation adéquate en échocardiographie, ce qui limite la portée de l’ETO [2,25].
- En chirurgie coronarienne, l'ETO diagnostique des ACS justifiant un traitement médical ou chirurgical dans 24% des cas ; le taux de reprise chirurgicale de pontages aorto-coronarien est de 3-5% [3,20].
- Chez les patients à haut risque ischémique, l’impact de l’ETO dans la prise en charge hémodynamique s’élève jusqu’à 51% des cas [7,20,26].
- La persitance d’ACS après revascularisation a une valeur pronostique pour les complications postopératoires [21].
- L’ETO permet le diagnostic de décompensations liées à l’ischémie comme l’insuffisance mitrale ou la dysfonction ventriculaire ; ceci est particulièrement important dans la chirurgie de l’aorte au moment du clampage, qui correspond à une augmentation brusque de la postcharge du VG.
- Dans le cadre de la chirurgie coronarienne à cœur battant (OPCAB), l’ETO a une meilleure sensibilité à l’ischémie que l’ECG ; sa valeur prédictive pour l’infarctus postopératoire est supérieure [21,30].
Bien que l'échocardiographie soit un moyen très sensible et très spécifique pour le diagnostic de l'ischémie myocardique, il ne s'avère pas que ce soit un moyen de surveillance peropératoire efficace en-dehors de la chirurgie coronarienne. Le diagnostic échocardiographique d’ischémie n'est fondé qu'en l'absence de perturbations hémodynamiques telles que la tachycardie, l'hypovolémie ou l'hypertension, qui peuvent être elles-mêmes à l'origine de perturbations de la cinétique segmentaire.
Le cathéter pulmonaire
Le rôle de la Swan-Ganz est très limité dans la surveillance de l’ischémie. Il faut que le territoire touché soit quantitativement très important pour que les modifications de compliance et de fonction systolique secondaires à l'ischémie se traduisent par des modifications apparaissant sur la PAPO: onde "a" > 15 mm Hg, onde "v" > 20 mm Hg, augmentation de plus de 15 mm Hg de la PAP diastolique. La sensibilité de cet élément pour l’ischémie et sa valeur prédictive d’infarctus sont décevantes, car seuls 13% de toutes les mesures de PAPO et 21% de tous les évènements ischémiques sont associés à des altérations morphologiques de la courbe de pression bloquée [19,27]. Comparées à la sécrétion de lactate dans le sinus coronaire, seule mesure objective de l’ischémie myocardique globale du VG, les modifications de la PAPO ne présentent pas de corrélation fiable avec les épisodes d’ischémie [13,14]. La Swan-Ganz peut déceler le retentissement hémodynamique secondaire à la souffrance ventriculaire, mais ne surveille pas l’apparition de l’ischémie.
Le cathéter artériel
On ne saurait trop insister sur l'importance du contrôle continu de la pression artérielle par monitorage invasif. En effet, derrière les sténoses et dans les collatérales le flux est pression-dépendant. Une baisse de la pression artérielle de plus de 30% a un pouvoir prédictif de 84% pour une ischémie péri-opératoire [19]. Comme la PAM en périphérie est la mesure la plus voisine de la pression aortique qui perfuse l'arbre coronarien, il est habituel de la maintenir au-dessus de 75 mmHg pour avoir une marge de sécurité. La fréquence étant l'élément majeur parmi ceux qui augmentent la consommation d'O2 myocardique, plusieurs index ont été imaginés pour déterminer les situations à risque pour le coronarien. Le plus simple est le rapport de Buffington [5] : c'est le rapport entre la pression artérielle moyenne et la fréquence cardiaque (PAM / FC). Ce rapport est une analogie du rapport DO2/VO2 ; chez les coronariens, il doit rester au-dessus de 1. Sa valeur d'alarme pour la survenue d’ischémie lorsqu’il devient < 1 est d’autant plus intéressante qu’il ne nécessite aucun équipement particulier. En anesthésie, il est plus pertinent que le double produit (PAsyst • FC) ou le triple produit (PAsyst • FC • PAPO). Toutefois, sa valeur prédictive positive est très limitée, alors que sa valeur prédictive négative est élevée [12] ; cela signifie que le risque d'ischémie est faible tant que la fréquence cardiaque d’un malade coronarien est inférieure à sa PAM, pour autant que toutes deux restent dans les limites physiologiques.
Les biomarqueurs
Le relargage de troponines est le marqueur le plus sensible d’une lésion myocardique. Même une faible élévation de leurs taux (troponine T > 0.02 ng/mL) reflète une lésion cellulaire significative et prédit une aggravation du pronostic cardiovasculaire postopératoire [22]. Les tests à haute sensibilité capables d’identifier des traces de troponine T (TnT-hs) permettent de détecter des lésions myocardiques minimes et d’augmenter la pertinence de l’évaluation périopératoire.
Le dosage préopératoire du BNP/NT-proBNP prédit assez bien le risque de décompensation ventriculaire, d'infarctus et de décès postopératoire. Ces complications surviennent chez 22% des patients dont la valeur préopératoire est au-dessus du seuil (BNP 92 ng/L, NT-proBNP 300 ng/L), comparé à 4.9% lorsque cette valeur est inférieure à ces seuils (OR 3.4) [24]. Le risque est proportionnel au taux des biomarqueurs: l'incidence de complications est de 5.1%, 11.6% et 26.3% lorsque le BNP est respectivement < 100, 100-250 ou > 250 ng/L; elle s'élève jusqu'à 39.5% lorsque le NT-proBNP est > 3000 ng/L [24]. La capacité discriminante du BNP et du NT-proBNP est du même ordre de grandeur que celle d'un test d'effort, comme le montre leur valeur prédictive: ROC 0.75 et 0.81, respectivement [15]. Pour affiner le pronostic préopératoire en chirurgie non-cardiaque et pour pouvoir juger de l'élévation postopératoire, il est donc actuellement suggéré (recommandation classe IIb, degré d'évidence B) de doser les biomarqueurs chez les patients à risque intermédiaire et majeur avant des interventions majeures [16]. Cette attitude permet de limiter les investigations cardiologiques (épreuves d'effort, IRM, coronarographie) aux patients chez qui elles ont le plus de chance d'être positives et de conduire à une modification de la prise en charge thérapeutique [9]. Mais ceci permet aussi de déceler des malades à troponines élevées que leur absence de symptômes n'aiguillerait pas vers des tests cardiologiques, alors qu'ils présentent un risque de complications cardiovasculaires de 5-40%.
Après chirurgie de revascularisation coronarienne, les troponines ne permettent pas de faire la différence entre une ischémie et les dégâts de l’intervention chirurgicale elle-même. Comme leur taux est proportionnel à la gravité de la lésion, elles restent un indicateur assez spécifique d’infarctus postopératoire, que la nécrose soit liée à l’acte chirurgical ou à une thrombose coronarienne (voir Chapitre 9 Infarctus en chirurgie cardiaque). Un taux postopératoire de troponine T supérieur à 1.5 mcg/L est un prédicteur efficace de la mortalité à 6 mois [10]. Malheureusement, son évolution dans le temps (pic à 12-24 heures) impose un certain délai diagnostique. La myoglobine est un marqueur plus précoce (1-3 heures après la lésion, pic à 6-12 heures), mais son élévation immédiate est peu spécifique après une opération; la persistence d’un taux élevé à 24 heures est un meilleur indice. D’autre part, la retransfusion de sang médiastinal complique le diagnostic biologique de l’infarctus, car cette autotransfusion augmente artificiellement le taux des marqueurs habituels.
Dans les trois premiers jours postopératoires de chirurgie non-cardiaque, une élévation momentanée du taux de troponine (≥ 0.02 ng/L) est associée à une augmentation de mortalité à 1 mois, bien que les trois quarts des patients soient asymptomatiques et les deux tiers sans signes ECG (voir Chapitre 9 Infarctus en chirurgie noncardiaque). Définie par les troponines à haute sensibilité (TnT-hs), une ischémie myocardique postopératoire est présente chez 8-19% des patients à risque intermédiaire et élevé, bien que 58% d’entre eux ne remplissent pas les critères d’un infarctus et que 84% soient asymptomatiques [4,28]. Ils souffrent de ce qu’il est convenu d’appeler MINS (Myocardial Injury after Noncardiac Surgery) [4,31]. Cette souffrance myocardique sans traduction clinique ni électrocardiographique correspond toutefois à une pathologie bien réelle, puisqu'elle est associée à une péjoration significative du pronostic et à une mortalité 3 fois plus élevée (OR 2.9) [23]. Cette mortalité est proportionnelle au taux de troponine. Ainsi, une élévation de 0.02 ng/L, 0.03-0.25 ng/L et de ≥ 0.3 ng/L est associée à une élévation de la mortalité postopératoire de 2.41, 5.0 et 10.5 fois respectivement [8,29]. La question est de savoir si la mise en évidence de MINS réclame une sanction thérapeutique, bien que le taux de troponine soit faible et l’ECG sans altération. Une étude portant sur 667 patients de chirurgie vasculaire a montré que le traitement correspondant à celui d’une ischémie myocardique stable asymptomatique est bénéfique: le risque de complication est nettement diminué (HR 0.63) chez les patients traités activement alors qu'il est augmenté chez ceux qui ne l'ont pas été (HR 2.8) [11]. Ce traitement est parfaitement concevable comme préparation préopératoire également.
Le délai moyen minimal d’une dizaine de jours entre l’élévation du marqueur et le décès laisse suffisamment de temps pour entreprendre une prise en charge immédiate de l’ischémie myocardique. Lorsque le taux de troponine est significatif et lorsque l’ECG est modifié, le traitement est celui d’une ischémie myocardique aiguë (voir Chapitre 9 Traitement, Ischémie aiguë). Lorsque le taux est faible et l’ECG sans altération, le traitement est celui d’une ischémie myocardique stable asymptomatique, équivalente à une prévention secondaire proactive : antiplaquettaires, statine, béta-bloqueur, inhibiteur de l’enzyme de conversion et, à long terme, modifications du style de vie.
Toutefois, l’élévation du taux de troponine postopératoire à des valeurs inférieures à celles admises pour le diagnostic non-équivoque d’infarctus est un marqueur de risque pour les complications cardiovasculaires et générales (embolie pulmonaire, insuffisance respiratoire, AVC, sepsis) plus que pour l’infarctus per se [28]. Même si elles sont liées à une ischémie myocardique, les troponines ne signent pas forcément une lésion nécrotique dans un ventricule. Ceci pose un problème de prise en charge, car il n’est pas anodin d’imposer à un patient le traitement agressif d’une ischémie myocardique aiguë s’il n’en souffre pas.
| Monitorage de l’ischémie coronarienne |
|
L'ECG, particulièrement l’analyse continue du segment ST, reste la technique de choix pour la surveillance de l’ischémie coronarienne ; il fonctionne en continu de manière automatique. L'ETO est efficace en cas de lésions tronculaires engendrant des anomalies contractiles segmentaires (chirurgie coronarienne), mais elle est très peu sensible à l’ischémie sous-endocardique (plus fréquente en chirurgie non-cardiaque) ; d’autre part, elle réclame une attention exclusive et une formation spécifique. Par contre, l’ETO démontre clairement les décompensations hémodynamiques liées à l'ischémie : dysfonction ventriculaire gauche ou droite, insuffisance mitrale.
La Swan-Ganz peut déceler le retentissement hémodynamique secondaire à la souffrance ventriculaire, mais n’est pas une technique de surveillance de l’ischémie coronarienne. Un cathéter artériel est fondamental pour maintenir le rapport PAM / FC > 1.
Les troponines sont un marqueur très sensible de lésions myocardiques aggravant le pronostic postopératoire (mortalité augmentée d’environ trois fois), même lorsque leur taux est faible.
|
© CHASSOT PG Août 2010, dernière mise à jour Août 2017
Références
- BARRON M. Transesophageal echocardiographic characterization of intramyocardial air. Anesth Analg 1997; 84:SCA61
- BERGQUIST BD, LEUNG JM, BELLOWS WH. Transesophageal echocardiography in myocardial revascularisation: I Accuracy of intraoperative real-time interpretation. Anesth Analg 1996 ; 82:1132-8
- BERGQUIST BD, BELLOWS WH, LEUNG JM. Transesophageal echocardiography in myocardial revascularisation: II. Influence on intraoperative decision making. Anesth Analg 1996 ; 82:1139-45.
- BOTTO F, ALONSO-COELLO P, CHAN MT, et al. Myocardial injury after noncardiac surgery: a large international prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology 2014; 120:564-78
- BUFFINGTON C. Hemodynamic determinants of ischemic myocardial dysfunction in the presence of coronary stenosis in the dog. Anesthesiology 1985; 63:651-62
- COMMUNALE ME, BODY SC, LEY C, et al. The concordance of intraoperative left ventricular wall-motion abnormalities and electrocardiographic ST segment changes. Anesthesiology 1998; 88:945-54
- COUTURE P, DENAULT A, LIMOGES P, et al. Mechanisms of hemodynamic changes during off-pump coronary artery bypass surgery. Can J Anaesth 2002; 49:835-40
- DEVEREAUX PJ, CHAN MT, ALONSO-COELLO P, et al. Association between post-operative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307:2295-304
- DEVEREAUX PJ, SESSLER DI. Cardiac complications in patients undergoing major noncardiac surgery. N Engl J Med 2015; 373:2258-69
- FELLAHI JL, GUEX X, RICHOMME X, et al. Short-and long-term prognostic value of ppostoperative cardiac troponin I concentration in patients undergoing coronary artery bypass grafting. Anesthesiology 2003; 99:270-4
- FOUCRIER A, RODSETH R, AISSAOUI M, et al. The long-term impact of early cardiovascular therapy intensification for postoperative troponin elevation after major vascular surgery. Anesth Analg 2014; 119:1053-63
- GORDON MA, URBAN MK, O'CONNOR T, BARASH PG. Is the pressure-rate quotient a predictor or indicator of myocardial ischemia as measured by ST segment changes in patients undergoing coronary artery bypass surgery ? Anesthesiology 1991; 74:848-53
- GORE JM, GOLDBERG RJ, SPODICK GH, et al. A community-wide assessment of the use of pulmonary artery catheters in patients with myocardial infarction. Chest 1987; 92:721-7
- HOHNER P, JOHANSSON G, HÄGGMARK S, et al. Evaluation of haemodynamic indices of myocardial ischemia in patients with coronary artery disease. Br J Anaesth 1993; 70:A23
- JAMES S, JHANJI S, SMITH A, et al. Comparison of the prognostic accuracy of scoring systems, cardiopulmonary exercise testing, and plams biomarkers: a single-centre observational pilot study. Br J Anaesth 2014; 112:491-7
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- LEUNG JM, O'KELLY B, BROWNER WS, et al. Prognostic importance of postbypass regional wall motion abnormalities in patients undergoing CABG surgery. Anesthesiology 1989; 71:16-23
- LEUNG JM, O'KELLY BF, MANGANO DT. Relationship of regional wall motion abnormalities to hemodynamic indices of myocardial supply and demand in patients undergoing CABG surgery. Anesthesiology 1990; 73:802
- LIEBERMAN RW, ORKIN FK, JOBES DR, et al. Hemodynamic predictors of myocardial ischemia during halothane anesthesia for coronary artery revascularisation. Anesthesiology 1983; 59:36-41
- MISHRA M, CHAUHAN R, SHARMA KK, et al. Real-time intraoperative transesophageal echocardiography – How useful ? Experience of 5’016 cases. J Cardiothorac Vasc Anesth 1998; 12:625-32
- MOISES VA, MESQUITA CB, CAMPOS O, et al. Importance of intraoperative transesophageal echocardiography during coronary artery surgery without cardiopulmonary bypass. J Am Soc Echocardiogr 1998; 11:1139-44
- NAGELE P, BROWN F, GAGE BF, et al. High-sensitivity cardiac troponin T in prediction and diagnosis of myocardial infarction and long-term mortality after noncardiac surgery. Am Heart J 2013; 166:325-32.e1
- OBERWEIS BS, SMILOWITZ NR, NUKALA S, et al. Relation of perioperative elevation of troponin to long-term mortality after orthopedic surgery. Am J Cardiol 2015; 115:1643-8
- RODSETH RN, BICCARD BM, LE MANACH Y, et al. The prognostic value of pre-operative and post-operative B-type natriuretic peptides in patients undergoing noncardiac surgery. J Am Coll Cardiol 2014; 63:170-80
- SAADA M, CAHALAN M, LEE E et al. Real-time evaluation of echocardiograms (abstract). Anesthesiology 1989; 71:A344
- SHANEWISE JS, ZAFFER R. Intraoperative echocardiography in coronary bypass graft surgery without cardiopulmonary bypass. J Am Coll Cardiol 1999; 33:471A
- VAN DAELE M, SUTHERLAND G, MITCHELL M, et al. Do changes in pulmonary capillary wedge pressure adequately reflect myocardial ischemia during anesthesia?. Circulation 1990; 81:865-71
- VAN WAES JA, NATHOE HM, DE GRAAFF JC, et al. Myocardial injury after noncardiac surgery and its association with short-term mortality. Circulation 2013; 127:2264-71
- VISION – The Vascular Events in Noncardiac Surgery Patients Cohort Evaluation study investigators. Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307:2295-304
- WANG J, FILIPOVIC M, RUDZITIS A, et al. Transesophageal echocardiography for monitoring segmental wall motion during off-pump coronary artery bypass surgery. Anesth Analg 2004; 99:965-73
- WESTERMANN D, NEUMANN JT, SÖRENSEN NA, et al. High-sensitivity assays for troponin in patients with cardiac disease. Nat Rev Cardiol 2017; 14:472-83
