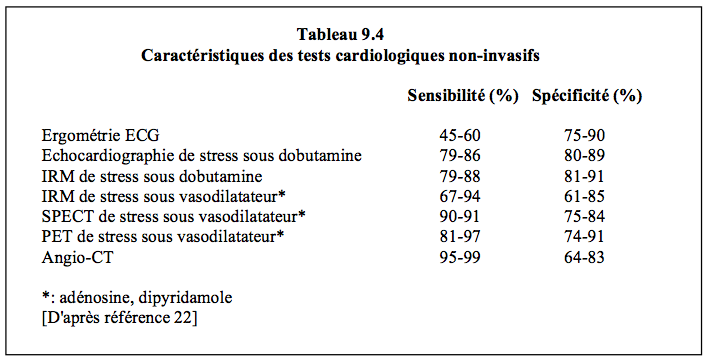
Les tests cardiologiques non-invasifs ont en moyenne une sensibilité et une spécificité de l'ordre de 85%, ce qui sous-entend que 15% des résultats sont erronés (Tableau 9.4). Dans ce contexte, les tests sont inutiles chez les patients dont la probabilité de souffrir de coronaropathie est inférieure à 15% ou supérieure à 85% [23]. Ils ne sont donc justifiés que chez les malades à probabilité intermédiaire. Les investigations cardiologiques portant sur la coronaropathie sont traitées plus en détail dans le Chapitre 03 (voir Investigations cardiologiques) ; elles ne sont abordées ici que pour rappel.
Ergométrie et épreuves de stress
L'ergométrie est l’examen de première intention chez les malades à probabilité intermédiaire de coronaropathie, mais il est limité par les anomalies électrocardiographiques (BBG, sous-décalage ST, pace-maker) qui empêchent son interprétation, et par l’incapacité du patient à courir ou à pédaler (voir Figure 3.2A). Le but est d’augmenter le travail cardiaque par paliers jusqu’à atteindre au minimum le 85% de la fréquence théorique maximale (FTM: 220 – âge chez l'homme, et 200 – âge chez la femme) ou un double produit (fréquence x pression systolique) supérieur à 25'000. Le taux de complications requérant une hospitalisation est de 0.01% [22]. Plusieurs réponses à l’effort dénotent une forte probabilité d’ischémie myocardique [25].
- Apparition d’angor typique.
- Sous-décalage du segment ST ≥ 1.0 mm (80 ms après le point J, ou 60 ms si fréquence > 130/min) de morphologie horizontale ou descendante.
- Sus-décalage du segment ST de ≥ 1.0 mm dans des dérivations sans onde Q ; cette modification est peu fréquente ; elle traduit une sténose proximale sévère, une zone hibernante ou un phénomène de Prinzmetal.
- Les modifications ascendantes du segment ST qui n’apparaissent qu’à l’effort intense et disparaissent en moins de 30 secondes à l’arrêt représentent en général un faux positif.
- Hypotension systolique ; elle est associée à une ischémie étendue, à une augmentation de mortalité et à un risque élevé d’arythmies ventriculaires.
- L’apparition précoce des symptômes et leur persistance après l’effort sont un élément diagnostic important.
Il se peut que les signes positifs ne se manifestent que pendant la phase de récupération, notamment l’extrasystolie ventriculaire. Le risque ischémique augmente significativement lorsque le patient n'a pas pu atteindre les 85% de la capacité d’effort maximale et/ou de la fréquence prédites, mais les résultats du test sont moins bien interprétables dans ces conditions. L’ergométrie a une spécificité modérée (80%), mais une sensibilité qui varie en fonction du nombre de vaisseaux coronariens sténosés : respectivement 40%, 60% et 70% pour des lésions mono-, bi- ou tritronculaires [18]. Sa sensibilité est moindre si le test est sous-maximal. Elle est moins fiable et plus complexe à interpréter chez les patients vasculaires et chez les femmes [10]. Lorsque le risque ischémique pré-test est bas, la probabilité de faux positif est significative, mais par contre l’apparition de signes ECG chez un patient à probabilité pré-test élevée commande une approche invasive (coronarographie). Le résultat de l’ergométrie doit donc être interprété selon la probabilité pré-test de la coronaropathie et non selon une dichotomie binaire positif-négatif. Comme il est facile et bon marché, l'ECG d'effort reste le premier choix parmi les tests de dépistage, notamment pace qu’il a une valeur prédictive négative élevée (98%) [25].
L’échocardiographie de stress sous dobutamine permet de quantifier la fonction segmentaire des 17 segments dans lesquels est divisé le VG (voir Figure 9.15) [3]. Chaque segment représente environ 5% de la masse myocardique du VG (voir Contractilité segmentaire). Avec la tachycardie et l’augmentation de contractilité dues à la dobutamine, la perfusion coronarienne ne peut plus subvenir aux besoins myocardiques en O2 dans les zones desservies par des vaisseaux sténosés ; il apparaît donc une hypokinésie ou une akinésie dans les segments correspondants (demand ischaemia) (Vidéos).
Vidéo: akinésie antéro-apicale avec dilatation de l'apex sur ischémie du territoire de l'IVA en vue mi-oesophagienne 4-cavités 0°.
Vidéo: akinésie antéro-apicale avec dilatation de l'apex sur ischémie du territoire de l'IVA en vue mi-oesophagienne 2-cavités 90°.
L’hypokinésie et l’akinésie surviennent lorsque le flux est diminué respectivement de 50% et de 80%. Les segments dont l’akinésie persiste sans changement au cours du test sont des zones infarcies ; ceux qui récupèrent une certaine activité à l’effort correspondent à des territoires hibernants, donc pouvant récupérer lors d’une revascularisation. Chaque segment est évalué sur une échelle de contractilité de 5 points : 1) normal, 2) hypokinésie légère, 3) hypokinésie sévère, 4) akinésie, 5) dyskinésie ; l’addition des points divisée par le nombre de segments observés fournit un score d’ischémie. Le pronostic est fonction du nombre de segments touchés, de leur degré d’altération cinétique, de leur localisation et de la durée nécessaire à la récupération de leur contractilité. Alors qu’elle a une sensibilité (85%) voisine de celle de la scintigraphie, l’écho de stress est plus spécifique, mais cette spécificité est fonction du nombre de vaisseaux atteints : elle est respectivement de 69%, 89% et 100% en cas de maladie mono-, bi- ou tritronculaire [9]. Sa valeur prédictive négative est très élevée (> 95%), mais sa valeur prédictive positive reste modeste (25-45%) [27]. Elle a une forte valeur prédictive chez les patients à risque intermédiaire ou élevé, et chez les malades de chirurgie vasculaire [18]. L'échocardiographie permet la quantification de la fonction globale du VG (fraction d'éjection), qui est un prédicteur majeur de la survie à long terme: un malade avec une FE < 0.5 a une mortalité annuelle > 3% du seul fait de sa dysfonction gauche [23]. La présence d’une sténose aortique serrée ou d’une sténose sous-aortique dynamique sont des contre-indications relatives à l'écho de stress.
Vidéo: akinésie antéro-apicale avec dilatation de l'apex sur ischémie du territoire de l'IVA en vue mi-oesophagienne 4-cavités 0°.
Vidéo: akinésie antéro-apicale avec dilatation de l'apex sur ischémie du territoire de l'IVA en vue mi-oesophagienne 2-cavités 90°.
L’hypokinésie et l’akinésie surviennent lorsque le flux est diminué respectivement de 50% et de 80%. Les segments dont l’akinésie persiste sans changement au cours du test sont des zones infarcies ; ceux qui récupèrent une certaine activité à l’effort correspondent à des territoires hibernants, donc pouvant récupérer lors d’une revascularisation. Chaque segment est évalué sur une échelle de contractilité de 5 points : 1) normal, 2) hypokinésie légère, 3) hypokinésie sévère, 4) akinésie, 5) dyskinésie ; l’addition des points divisée par le nombre de segments observés fournit un score d’ischémie. Le pronostic est fonction du nombre de segments touchés, de leur degré d’altération cinétique, de leur localisation et de la durée nécessaire à la récupération de leur contractilité. Alors qu’elle a une sensibilité (85%) voisine de celle de la scintigraphie, l’écho de stress est plus spécifique, mais cette spécificité est fonction du nombre de vaisseaux atteints : elle est respectivement de 69%, 89% et 100% en cas de maladie mono-, bi- ou tritronculaire [9]. Sa valeur prédictive négative est très élevée (> 95%), mais sa valeur prédictive positive reste modeste (25-45%) [27]. Elle a une forte valeur prédictive chez les patients à risque intermédiaire ou élevé, et chez les malades de chirurgie vasculaire [18]. L'échocardiographie permet la quantification de la fonction globale du VG (fraction d'éjection), qui est un prédicteur majeur de la survie à long terme: un malade avec une FE < 0.5 a une mortalité annuelle > 3% du seul fait de sa dysfonction gauche [23]. La présence d’une sténose aortique serrée ou d’une sténose sous-aortique dynamique sont des contre-indications relatives à l'écho de stress.
Résonance magnétique nucléaire
L’IRM de stress (perfusion myocardique au gadolinium sous adénosine ou sous dobutamine) représente la meilleure alternative en cas d’échogénicité insuffisante pour une échocardiographie (voir Chapitre 03 IRM). Un enregistrement de 3 coupes en court-axe permet de visualiser 16 segments myocardiques. La sensibilité et la spécificité sont de 82% et 75% en moyenne [4,14,23]. En enregistrant les images 10-20 minutes après la perfusion de gadolinium (late gadolinium enhancement), qui ne pénètre pas les membranes cellulaires saines, on peut différencier l’état de la région ischémique : obstruction microvasculaire (zone sombre), oedème (zone à risque), cicatrice (infarctus), ou hibernation (zone non fonctionnelle mais viable) [2,14]. L’avantage principal est une remarquable évaluation de la viabilité du tissu, donc de sa capacité à récupérer lors d’une revascularisation. L'excellente résolution spatiale de l'IRM lui permet de détecter des infarctus de l'ordre de 1 gm de tissu myocardique [2]. Comme le pronostic clinique est fonction de la taille de l'infarctus, une augmentation de volume de 5% correspond à une élévation de 20% du risque d'insuffisance ventriculaire et de mortalité [31]. De plus, les thrombus intracavitaires sont très bien différenciés. Le gadolinium est contre-indiqué lorsque la clairance de la créatinine est < 30 mL/min.
Imageries de la perfusion myocardique
L’utilisation combinée d’un radiotraceur absorbé par les cellules myocardiques et d’un vasodilatateur permet d’évaluer la qualité du flux coronarien (voir Chapitre 03 Imageries de perfusion). Comme le lit vasculaire est maximalement dilaté au repos derrière une sténose, l’agent vasodilatateur augmente le flux dans les zones saines seulement, ce qui baisse la pression de perfusion à travers la sténose et induit un phénomène de vol sur la zone ischémiée dont la perfusion diminue. Deux agents sont utilisés à cet effet : le dipyridamole, qui bloque les récepteurs de l’adénosine et augmente la concentration libre de cette dernière, et l’adénosine, qui est le vasodilatateur physiologique dont la durée de vie est de quelques secondes.
La scintigraphie au thallium-dipyridamole par gamma-caméra utilise les propriétés du thallium-201 de pénétrer rapidement dans les cellules myocardiques de manière analogue au potassium, en combinaison avec l’effet vasodilatateur du dipyridamole sur les territoires sains. Le tissu normal présente les mêmes images au repos et sous dipyridamole, alors que les zones présentant une ischémie active n’affichent le traceur que dans les séquences au repos ; elles apparaissent comme des zones muettes sous l’effet du dipyridamole. Les zones infarcies affichent les mêmes défauts de perfusion aux deux temps (défauts fixes) (voir Figure 3.2B). La scintigraphie au technetium-99m (99mTc sestamibi et 99mTc tetrofosmine) permet une analyse analogue des défauts de perfusion. La technique scintigraphie permet en outre d’apprécier la cinétique des parois ventriculaires, de quantifier leur taille, et de calculer la fonction globale des ventricules [18]. Alors que sa valeur prédictive négative est élevée (99%), la sensibilité (90%) et la spécificité (80%) de la scintigraphie sont plus modestes [29].
La tomographie computérisée par émission de photon (SPECT) et la tomographie par émission de positrons (PET-scan) utilise les isotopes de certains éléments comme le carbone, l’azote, l’oxygène ou le fluor (18F-fluoro-déoxy-glucose) qui ont la particularités d’émettre des positrons. On peut alors suivre ces éléments avec une caméra et obtenir des images de la perfusion (en mL/min) ou du métabolisme glucidique myocardique (moles/gm/min) selon que l’élément reste extracellulaire ou est métabolisé. Ces techniques permettent de déterminer quelles sont les lésions ischémiantes chez un malade multitronculaire et d'évaluer la viabilité des zones ischémiées. De larges défauts de perfusion induits par le stress ou des défauts survenant dans plusieurs territoires coronariens, accompagnés d'une dilatation ventriculaire, sont des facteurs de mauvais pronostic [23].
Angio-CT
L’angio-CT (CT multi-barrettes) permet de visualiser les artère coronaires épicardiques et de réaliser une coronarographie non invasive (voir Figure 3.5). Sa résolution spatiale (0.4 mm) et temporelle (100 msec) restent toutefois inférieures à celle de l’angiographie. Sa sensibilité est de 95% et sa spécificité de 76% [23,28]. La quantification du calcium déposé dans l’arbre coronarien permet d’établir un score (score d'Agatston) à portée pronostique sur le risque d’ischémie clinique. Son association avec l’évaluation des caractéristiques des plaques athéromateuses et du degré d’obstruction coronarienne affine les possibilités de prévoir les risques de syndrome coronarien aigu [26]. Comme il a une valeur prédictive négative très élevée (99% pour l'absence de sténose > 50%), le CT-scan permet d’exclure efficacement une maladie coronarienne lorsqu’il est normal, mais il ne remplace pas l’angiographie pour la définition précise des lésions coronariennes lorsqu’il en décèle [7,26,28]. Il est surtout indiqué chez les patients qui ont une probabilité intermédiaire (20-80%) de souffrir d'une coronaropathie [35]. Ses indications peuvent être réparties en quatre catégories [7].
- Syndrome coronarien aigu: très disponible en urgence, l'angio-CT permet de confirmer ou d'exclure (rule-in or rule-out) la présence d'une coronaropathie obstructive dans le territoire suspecté à l'ECG lorsque les troponines ne sont pas diagnostiques [13]. Il permet également le diagnostic différentiel avec d'autres causes de douleur thoracique: embolie pulmonaire, dissection aortique, péricardite, etc.
- Investigations avant chirurgie non-cardiaque : angor instable chez un patient symptomatique à risque intermédiaire ou élevé, tests fonctionnels (stress) non conclusifs ; bien qu’il ne procure pas d’information sur la perfusion myocardique, le CT-scan a l’avantage de fournir une vision anatomique de l’arbre coronarien et du cœur.
- Chirurgie cardiaque : dépistage de coronaropathie avant une intervention valvulaire ou avant une autre opération cardiaque non-coronarienne ; sa haute valeur prédictive négative et sa moindre invasivité en font un bon test en remplacement de la coronarographie pour exclure une intervention coronarienne.
- Chirurgie de revascularisation coronarienne : la coronarographie reste indispensable pour la définition précise des lésions coronariennes chirurgicales, mais le CT-scan lui est supérieur pour la visualisation des structures lors de reprise chirurgicale : position des pontages précédents, trajet de la mammaire interne, anatomie de la paroi sternale et des cavités cardiaques ; il permet également une bonne définition des calcifications présentes dans la paroi de l’aorte ascendante.
L'angio-Ct avec produit de contraste présente une sensibilité de 93% et une spécificité de 87% pour la détection d'un infarctus aigu [9,21], mais il n'améliore pas la portée diagnostique par rapport à l'écho de stress, à l'épreuve d'effort ou à la scintigraphie [6]. Par contre, il est rapide, simple et facile d'accès; de plus, son apport diagnostique dans le syndrome coronarien aigu diminue le risque d'infarctus et de mortalité sans augmenter le taux de coronarographie [24]. Il demande toutefois une capacité à retenir sa respiration, un rythme sinusal et une fréquence cardiaque de 50-70 batt/min.
Angiographie coronarienne
La coronarographie consiste à introduire un cathéter dans l’ostium du tronc coronaire et à y injecter du produit de contraste pour visualiser les trois troncs coronariens et leurs principales banches (jusqu’à une lumière de 1 mm) (voir Figures 3.6 et 3.7). La ponction se fait pas voie fémorale, humérale ou radiale ; cette dernière a la préférence, car elle offre l’avantage de limiter le risque hémorragique en facilitant l’hémostase par compression chez les malades sous antithrombotiques et antiplaquettaires. Le degré de sténose des vaisseaux est quantifié en pourcentage de rétrécissement de la lumière ; le seuil de signification est un rétrécissement de diamètre de > 50% (rétrécissement de surface de section > 75%). Il est également défini en terme de longueur et de tortuosité de la sténose. La coronarographie présente certains risques: son taux de complications graves est de 0.5-2% et son risque de mortalité, d'infarctus ou d'ictus est de 0.1-0.2% [19,23]. Elle n'a de sens que si elle s'adresse à des malades qui peuvent potentiellement bénéficier d'une revascularisation. Ce sont [35]:
- Syndrome coronarien aigu, angor instable stade III-IV;
- Angor ne répondant pas au traitement médical, angor résiduel après infarctus ou revascularisation, angor et insuffisance cardiaque;
- Patients dont le test d'effort a révélé une coronaropathie significative ou est équivoque;
- Patients de > 45 ans (hommes) et de > 50 ans (femmes postménopause) devant subir une intervention de chirurgie cardiaque en CEC.
Si la valve aortique n’est pas sténosée, la coronarographie est complétée d’une ventriculographie qui permet d’évaluer la cinétique segmentaire, la fonction ventriculaire (fraction d’éjection) et la présence d’une insuffisance mitrale ou aortique. L’injection d’un bolus de produit de contraste hypertonique élève momentanément la pression télédiastolique du VG. L’intérêt majeur de la coronarographie est d’avoir une portée thérapeutique immédiate, puisqu’elle peut s’accompagner de l’aspiration du thrombus, de la dilatation du vaisseau incriminé (angioplastie) et de la pose de stent (voir Traitement interventionnel).
Autres investigations
Avec un capteur circulaire disposé à l'extrémité d'un cathéter, les ultrasons intravasculaires (IVUS, intravascular ultrasound) permettent de mesurer avec précision la dimension d'un vaisseau ou d'un rétrécissement et de vérifier le déploiement optimal d'un stent [20].
La tomographie par cohérence optique (OCT, optical cohérence tomography) offre une résolution plus fine que celle des ultrasons; elle est utile pour évaluer la morphologie des plaques athéromateuses et le déploiement d'un stent [20].
Autres investigations
Avec un capteur circulaire disposé à l'extrémité d'un cathéter, les ultrasons intravasculaires (IVUS, intravascular ultrasound) permettent de mesurer avec précision la dimension d'un vaisseau ou d'un rétrécissement et de vérifier le déploiement optimal d'un stent [20].
La tomographie par cohérence optique (OCT, optical cohérence tomography) offre une résolution plus fine que celle des ultrasons; elle est utile pour évaluer la morphologie des plaques athéromateuses et le déploiement d'un stent [20].
Réserve fonctionnelle
Pour suivre la demande en O2 lors d'un effort, la perfusion myocardique périphérique est susceptible d'augmenter de 3 à 5 fois. Cette élévation définit la réserve fonctionnelle: c'est le rapport entre le flux en hyperémie et le flux au repos. Ce rapport est sérieusement abaissé en présence d'une sténose coronarienne, car le flux maximal diminue de manière beaucoup plus importante que le flux au repos. La signification fonctionnelle d'une sténose est ainsi différente du degré de rétrécissement dans près de la moitié des lésions coronaires stables [15]. La fraction de flux de réserve (FFR, fractional flow reserve) est le rapport entre le flux dans une artère sténotique et le flux dans la même artère en vasodilatation maximale. Sa valeur normale est > 1 ; plus la sténose est serrée, plus le rapport diminue (Voir Chapitre 05, Sténose coronarienne). C’est un index spécifique de la sévérité fonctionnelle des sténoses épicardiques. En coronarographie, il est beaucoup plus facile de mesurer la pression que le flux, raison pour laquelle on utilise le rapport entre la pression aortique et la pression moyenne distale à la lésion (mesurée par le cathéter glissé au travers de la sténose) : Pdist / Pao [17]. Pour minimiser l’effet de la résistance artériolaire périphérique, on produit une hyperémie maximale par administration de vasodilatateur intracoronarien (adénosine, papavérine, nicorandil) et l’on enregistre la mesure au nadir de la Pdist [33]. Un index < 0.8 est actuellement considéré comme un critère d’ischémie active et une indication à la revascularisation. Comparée aux indications anatomiques de l'angiographie chez les polytronculaires (sténose > 70%), l’évaluation de la FFR permet de mieux cibler les vaisseaux à revasculariser. Revasculariser en fonction de la FFR plutôt que de l'anatomie diminue significativement le taux de mortalité, d’infarctus et de revascularisation itérative à 1 an (HR 0.65), car les lésions non-ischémiantes ont un excellent pronostic avec un traitement médical alors que les lésions ischémiantes bénéficent largement d'une revascularisation [32]. Comparée au traitement médical seul dans la coronaropathie stable, la PCI des lésions ayant une FFR < 0.8 abaisse la mortalité et le risque d’infarctus de près de 70% (OR 0.32) [5]. Elle conduit à réorienter 43% des patients entre traitement médical ou angioplastie par rapport à ce qui aurait été décidé sur les seuls critères angiographiques [34]. D'une manière générale, plus la FFR est basse, plus les malades bénéficient d'une revascularisation [15]. Le calcul de la FFR est surtout utile pour déterminer quelles lésions méritent une revascularisation dans les lésions stables intermédiaires et chez les tritronculaires [20]. Il n'est pas nécessaire dans les sténoses serrées (> 90%). Dans les lésions situées en-dehors du vaisseau incriminé lors d'infarctus STEMI, la question se pose entre une revascularisation complète ou une revascularisation limitée au seul vaisseau responsable de la lésion aiguë (culprit-lesion only treatment); en suivant les données de la FFR, la revascularisation de toutes les lésions fonctionnellement significatives diminue considérablement le risque de mortalité, d'infarctus et de revascularisation secondaire (HR 0.35) par rapport à la revascularisation de la seule lésion responsable du STEMI avec traitement médical pour les autres lésions [8,30]. La FFR permet également d'orienter la chirurgie, car les greffons anastomosés à des lésions fonctionnellement non-significatives tendent à thromboser à cause du flux compétitif de l'artère native. Lorsque le choix des vaisseaux à ponter est basé sur la FFR, le taux d'occlusion des greffons est 2.5 fois moindre [1].
Pour éviter l'administration de vasodilatateur, ont peut mesurer le rapport entre la pression aortique moyenne et la pression distale minimale en diastole (iFR, instantaneous wave-free ratio); ce rapport évalue le gradient de pression à travers une sténose lorsque les résistances microvasculaires sont basses et stables. La comparaison d'une stratégie de revascularisation basée sur l'iFR ou la FFR ne révèle pas de différence significative dans le risque d'infarctus, de revascularisation secondaire ou de resténose [11].
Alors que la FFR et l'iFR la mesurent par le biais des pressions, le PET-scan évalue la réserve fonctionnelle (CFR, coronary flow reserve) au moyen des flux au repos et sous stress. La FFR est sensible au degré de sténose mais non à la microcirculation prériphérique; le PET, au contraire, est influencé par cette dernière. De ce fait, leurs résultats peuvent diverger selon l'importance de chacun des deux éléments dans la diminution du flux coronarien; c'est le cas chez 20% des patients. Le seuil pour une ischémie significative est une FFR ≤ 0.8 et une CFR ≤ 1.74 [12]. Le PET-scan présente l'avantage de sa non-invasivité par rapport à la coronarographie; il est un moyen élégant de sélectionner les malades chez lesquels une angiographie coronarienne est profitable, tels ceux qui présentent des défects dans 10-15% des la masse du VG à un niveau d'activité de 60% [16].
On peut obtenir des coronarographies de haute qualité par angio-IRM, mais limitées aux vaisseaux proximaux, parce que la tortuosité des petits vaisseaux qui entourent le coeur et la résolution spatiale plus faible que celle de l’angiographie limitent les performances de l’IRM; de plus, les calcifications vasculaires ne sont pas visibles. La résolution temporelle et l’imagerie dynamique de l’IRM sont supérieures à celles de l’angio-CT.
| Investigations coronariennes |
|
ECG d’effort : simple, peu onéreux et non-invasif, mais dépend de la mobilité du patient et de la fiabilité de l’ECG pour l’ischémie.
Scan Thallium-dipyridamole : diagnostic des zones d’ischémie active et des zones infarcies, mais coûteux et utilisation de matériel radio-actif.
Echo de stress dobutamine : diagnostic des zones d’ischémie active et des zones infarcies, fonction ventriculaire ; le plus sensible mais dépend de l’opérateur et de l’échogénicité du malade.
La sensibilité des test d’effort augmente avec le nombre de vaisseaux coronariens sténosés à > 70%.
Les tests d’effort ne sont pas sensibles pour les plaques instables.
IRM : complexe et coûteux, mais précision maximale dans le diagnostic anatomo-pathologique et ischémique ; mesure la plus précise des volumes ventriculaires et de la viabilité myocardique.
Angio-CT : imagerie coronarienne non-invasive avec haute valeur prédictive négative, mais insuffisante pour le diagnostic cardio-chirurgical précis des lésions coronariennes.
Coronarographie : invasive et coûteuse ; indiquée chez les patients candidats à une revascularisation (angor instable, angor réfractaire, syndrome coronarien aigu, patients de chirurgie cardiaque > 50 ans).
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- BAIBHAV B, GEDELA M, MOULTON M, et al. Role of invasive functional assessment in surgical revascularization of coronary artery disease. Circulation 2018; 137:1731-9
- BULLUCK H, DHARMAKUMAR R, ARAI AE, et al. Cardiovascular magnetic resonance in acute ST-segment-elevation myocardial infarction. Circulation 2018; 137:1949-64
- CERQUEIRA MD, WEISSMAN NJ, DILSIZIAN V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: Statement for healthcare professionals from the cardiac imaging committee of the Council on clinical cardiology of the American Heart Association. Circulation 2002; 105:539-42
- DANIAS PG, ROUSSAKIS A, IONNIDIS JP. Diagnostic performance of coronary magnetic resonance angiography as compared against conventional X-ray angiography: a meta-analysis. J Am Coll Cardiol 2004:44:1867-76
- DE BRUYNE B, PIJLS NHJ, KALESAN B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med 2012; 367:991-1001
- DOUGLAS PS, HOFFMANN U, PATEL MR, et al. Outcomes of anatomical versus functional testing for coronary artery disease. N Engl J Med 2015; 372:1291-300
- DURST R, BOGOT N, GILON D, DRENGER B. Potential role for coronary computerized angiography for assessing preoperative ischemic risk. J Cardiothorac Vasc Anesth 2010; 24:348-55
- ENGSTRØM T, KALBAEK H, HELQVIST S, et al. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3-PRIMULTI): an open-label, randomised controlled trial. Lancet 2015; 386:665-71
- GARG P, UNDERWOOD R, SENIOR R, et al. Noninvasive cardiac imaging in suspected acute coronary syndrome. Nat Rev Cardiol 2016; 13:266-75
- GAUSS A, RÖHM HJ, SCHÄUFFELEN A, et al. Electrocardiographic exercise stress testing for cardiac risk assessment in patients undergoing noncardiac surgery. Anesthesiology 2001 ; 94:38-46
- GÖTBERG M, CHRISTIANSEN EH, GUDMUNDSDOTTIR IJ, et al. Instantaneous wave-free ratio versus functional flow reserve to guide PCI. N Engl J Med 2017; 376:1813-23
- GOULD KL, JOHNSON NP, BATEMAN TM, et al. Anatomic versus physiologic assessment of coronary artery disease. Role of coronary flow reserve, fractional flow reserve, and positron emission tomography imaging in revascularization decision-making. J Am Coll Cardiol 2013; 62:1639-53
- HOLLANDER JE, THAN M, MUELLER C. State-of-the-art evaluation of emergency department patients presenting with potential acute coronary syndromes. Circulation 2016; 134:547-64
- INGKANISORN WO, KWONG RY, BOHME NS, et al. Prognosis of negative adenosine stress magnetic resonance in patients presenting to an emergency department with chest pain. J Am Coll Cardiol 2006; 47:1427-32
- JEREMIAS A, KIRTANE AJ, STONE GW. A test in context. Fractional flow reserve: accuracy, prognostic implications, and limitations. J Am Coll Cardiol 2017; 69:2748-58
- JOHNSON NP, GOULD KL, DI CARLI MF, et al. Invasive FFR and noninvasive CFR in the evaluation of ischemia. What is the future ? J Am Coll Cardiol 2016; 67:2772-88
- KERN MJ, SAMADY H. Current concepts of integrated coronary physiology in the catheterization laboratory. J Am Coll Cardiol 2010; 55:173-85
- KERTAI MD, BOERSMA E, BAX JJ, et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart 2003; 89:1327-34
- LEVINE GN, BATES ER, BLANKENSHIP JC, et al. 2011 ACCF/AHA/SCAI Guideline for percutaneous coronary intervention: executive summary. Circulation 2011; 124:2574-609
- LOTFI A, JEREMIAS A, FEARON WF, et al. Expert Consensus Statement on the use of fractional flow reserve, intravascular ultrasound, and optical coherence tomography: a Consensus Statement of the Society of Cardiovascular Angiography and Interventions. Catheter Cardiovasc Interv 2014; 83:509-18
- MANO Y, ANZAI T, YOSHIZAWA A, et al. Role of non-electrocardiogram-gated contrast-enhanced computed tomography in the diagnosis of acute coronary syndrome. Heart Vessels 2013; 30:1-8
- MASLOW A, GERVINO E, LOWENSTEIN E. Stress Testing. In: THYS DM, HILLEL Z, SCHWARTZ AJ. Textbook of cardiothoracic anesthesiology. New York:McGraw-Hill Co, 2001, 203-232
- MONTALESCOT G, SECHTEM U, ACHENBACH S, et al. 2013 ESC Guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34:2949-3003
- NEWBY DE, ADAMSON PD, BERRY C, et al. Coronary CT angiography and 5-year risk of myocardial infarction. N Engl J Med 2018; 379:924-33
- PANTET O, MONNEY P, AEBISCHER N. Le point sur l’ergométrie en 2012 dans le diagnostic de la maladie coronarienne. Forum Med Suisse 2012; 12:578-84
- PERRONE-FILARDI P, MUSELLA F, SAVARESE G, et al. Coronary computed tomography: current role and future perspectives for cardiovascular risk stratification. Eur Heart J Cardiovasc Imaging 2012; 13:453-8
- POLDERMANS D, BAX JJ, BOERSMA E, et al. Guidelines for pre-operative risk assessment and perioperative management in non-cardiac surgery. The Task Force for Preoperative Cardiac Risk Assessment and Perioperative Cardiac Management in Non-cardiac Surgery of the European Society of Cardiology (ESC) and endorsed by he European Society of Anaesthesiology (ESA). Eur Heart J 2009; 30:2769-812
- ROBERTS WT, BAX JJ, DAVIES LC. Cardiac CT and CT coronary angiography: Technology and application. Heart 2008; 94:781-92
- SECHTEM U, ACHENBACH S, FRIEDRICH M, et al. Non-invasive imaging in acute chest pain syndromes. Eur Heart J Cardiovasc Imaging 2012; 13:69-78
- SMITS PC, ABDEL-WAHAB M, NEUMANN FJ, et al. Fractional flow reserve-guided multivessel angioplasty in myocardial infarction. N Engl J Med 2017; 376:1234-44
- STONE GW, SELKER HP, THIELE H, et al. Relationship between infarct size and outcomes following primary PCI: patient-level analysis from 10 randomized trials. J Am Coll Cardiol 2016; 67:1674-83
- TONINO PAL, DE BRUYNE B, PIJLS NHJ, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med 2009; 360:213-24
- TOTH GG, JOHNSON NP, JEREMIAS A, et al. Standardization of fractional flow reserve measurements. J Am Coll Cardiol 2016; 68:742-53
- VAN BELLE E, RIOUFOL G, POUILLOT C, et al. Revascularization strategy – Reclassification with fractional flow reserve (FFR) at time of diagnostic angiography: insights from a large French multicenter fractional flow reserve registry. Circulation 2014; 129:173-85
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
