Les reins reçoivent 20% du débit cardiaque, mais ne consomment que 10% de l'oxygène transporté. Les glomérules filtrent passivement le plasma; ils reçoivent la majorité du flux plasmatique rénal (FPR), mais consomment très peu d'O2 par rapport à la medulla. La médullaire, au contraire, a un débit sanguin 5-10 fois plus faible, mais elle consomme beaucoup d'O2 car elle opère tout le travail de concentration active de l'urine; elle est donc beaucoup plus sensible à l'ischémie et à l'hypovolémie [6]. La filtration glomérulaire (GFR) est directement proportionnelle à la pression hydrostatique intravasculaire et inversement proportionnelle à la pression oncotique (normalement 25 mmHg). La GFR diminue avec l'âge; de 125 mL/min chez le jeune adulte, elle passe à 80 mL/min à 60 ans et à 60 mL/min à 80 ans [59].
Si la pression artérielle baisse, l’autorégulation rénale maintient le FPR et la filtration glomérulaire par vasodilatation des artérioles préglomérulaires (mécanisme myogène) et par vasoconstriction des artérioles postglomérulaires (angiotensine II). Lorsque la perfusion rénale diminue de plus de 50% pendant 1 heure, la GFR baisse proportionnellement beaucoup plus que le FPR; le FPR est alors réparti préférentiellement vers la zone corticale profonde et vers la médullaire. La baisse du débit cardiaque et de la pression de perfusion entraîne une stimulation sympathique, une sécrétion de vasopressine et d'ADH, et l'activation du système rénine-angiotensine; tous ces phénomènes concourent à retenir de l'eau et du sodium par le rein [2]. L'hémodilution de la CEC augmente le flux plasmatique rénal et baisse les résistances vasculaires intraparenchymateuses, mais diminue l'apport d'O2. L'hypothermie et la non-pulsatilité induisent une vasoconstriction préférentiellement corticale.
Normalement, les fonctions rénales ne sont pas significativement modifiées, ni par l'anesthésie, ni par l'opération, ni par la CEC; les tests habituels comme le taux ou la clairance de la créatinine sont peu altérés dans la majorité des cas, mais ils ne sont ni suffisamment sensibles ni suffisamment précoces pour instituer un traitement avant le développement de lésions fonctionnelles. Des altérations subtiles sont cependant décelables par des mesures plus fines comme certains biomarqueurs, tels le NGAL, le KIM-1 ou la cystatine C [16,18]; la variation de la clearance à la créatinine lors d'une surcharge protéique, qui mesure la réserve fonctionnelle rénale, diminue pendant plusieurs semaines après une CEC [41]. Toutefois, la valeur prédictive de ces tests pour le développement d'une néphropathie aiguë reste modeste [23]. Par contre, cette dysfonction mineure peut venir amplifier les retombées d'une altération fonctionnelle préexistante mais infraclinique (artériopathie, âge, etc) ou être potentialisée par des évènements peropératoires: hypotension, médicaments néphrotoxiques, etc. Les études comparant la manière de règler le pH, l'hypothermie versus la normothermie, le flux pulsatile versus le flux non-pulsatile, n'ont pas pu, jusqu'ici, mettre en évidence un avantage significatif d'une technique de CEC sur une autre dans la préservation de la fonction rénale [53].
Cependant, la pression de perfusion et l'apport d'O2 (DO2) sont certainement les facteurs-clefs. On a démontré depuis longtemps que, dans un tiers des cas, la variation de la créatinine postopératoire était dépendante de la PAM pendant la CEC, pour autant que le débit de la pompe et le volume circulant soient normaux [62]. Le DO2 rénal est déterminant pour la survie fonctionnelle du rein. Or la CEC le diminue de 20% par vasoconstriction et hémodilution; l'extraction d'O2 par le parenchyme rénal augmente de 40%. Ces phénomènes se poursuivent pendant les premières heures postopératoires [33]. Ils ne sont pas corrigés par l'administration de cristalloïde ni de colloïde pour maintenir la normovolémie [56]. Il n'est donc pas surprenant que l'hémodilution soit un facteur de risque pour la dysfonction rénale; l'Ht devrait rester ≥ 26-28% [49].
Le débit urinaire est en général abaissé en cours de CEC, mais il est un prédicteur peu discriminant de la néphropathie aiguë. Une valeur < 0.5 mL/kg/h pendant la pompe est en général considérée comme seuil prédictif de dysfonction postopératoire, mais il est lié à de nombreux facteurs confondants prérénaux [12]. Seul un débit > 1.5 mL/kg/h assure que la fonction rénale soit normale dans les suites opératoires. L'association entre le bas débit urinaire et l'insuffisance rénale secondaire est plus nette lorsque la pression artérielle est basse (PAM < 80 mmHg) [24].
Insuffisance rénale postopératoire
La version révisée des classifications RIFLE et AKIN qui a la cote actuellement est la nomenclature KDIGO (Kidney Disease Improving Global Outcomes): l’insuffisance rénale postopératoire est subdivisée en quatre degrés de gravité en fonction du taux de créatinine sérique et du débit urinaire [5,32].
- Stade I : augmentation du taux de créatinine de 25 μmol/L ou 1.5-1.9 fois la valeur de base, débit urinaire < 0.5 mL/kg/h pendant 6-12 heures.
- Stade II : augmentation du taux de créatinine de 2-2.9 fois la valeur de départ, débit urinaire < 0.5 mL/kg/h pendant > 12 heures.
- Stade III : augmentation du taux de créatinine à ≥ 350 mcmol/L ou > 3 fois la valeur de départ, débit urinaire < 0.3 mL/kg/h pendant > 24 heures ou anurie pendant > 12 heures, ou hémodialyse/hémofiltration.
- Stade IV : anurie de longue durée (> 4 semaines) nécessitant une dialyse définitive.
Cette détérioration clinique est précédée par un dommage tissulaire infraclinique caractérisé par une élévation des biomarqueurs comme le NGAL ou la combinaison IGFBP7 (voir Chapitre 23, Complications rénales) [25].
L'incidence de la défaillance rénale (stades III et IV) après chirurgie cardiaque en CEC est globalement de 3-6%; la simple dysfonction rénale (stades I et II) est plus fréquente: 15-22% [15,25,26]. Elle est fonction du type d'opération: 7.7% après chirurgie du VG, 3.9% après chirurgie valvulaire, et 0.5% après PAC. Lorsque la dialyse est nécessaire (3% des cas), la mortalité est élevée: 30% chez les adultes et 45% chez les enfants [15,43]. La dysfonction postopératoire transitoire (créatinine 150-250 mcmol/L, augmentation de 20-25%) est plus fréquente: elle survient chez 11-22% des patients et se résout en quelques jours ou semaines [13,54]. Une diminution de 25-50% de la filtration glomérulaire est présente chez 24% des patients après chirurgie cardiaque. L'origine de l'insuffisance rénale qui peut survenir après CEC est multifactorielle. Parmi les éléments en cause, on peut citer par ordre probable d'importance [15,17,18,58,63].
- Etat clinique préopératoire:
- Néphropathie préopératoire (créatinine ≥ 200 mcmol/L); maladie rénale primaire, ou secondaire au diabète, à l’hypertension artérielle ou à une polyvasculopathie.
- Dysfonction ventriculaire gauche (FE < 0.35), contrepulsion intra-aortique.
- Age du patient (> 65 ans); la filtration glomérulaire passe normalement de 125 mL/min chez le jeune à 80 mL/min à 60 ans et < 60 mL/min à 80 ans (perte de réserve rénale de 0.75 mL/1.75 m2 par an à partir de 30 ans).
- Comorbidités : diabète, hypertension, artériopathie, BPCO, prescription d'IEC.
- Baisse du flux plasmatique rénal entraînant une hypoxie tissulaire:
- Hypovolémie et hypotension systémique (PAM < 30% de la norme pendant plus de 10 minutes).
- Bas débit en CEC (< 1.8 L/min/m2) et en postopératoire (IC < 2 L/min/m2); DO2 < 250 mL/min/m2.
- Congestion veineuse systémique (PVC > 12 mmHg).
- Congestion rénale sur hypervolémie (syndrome du compartiment rénal).
- Utilisation de vasoconstricteurs artériels alpha (à l'exception de la terlipressine).
- Etat septique.
- Dans 75% des cas, la néphropathie aiguë est liée à une sepsis et/ou un collapsus circulatoire.
- Effets de la chirurgie:
- Opération complexe, reprise.
- Clampage aortique versus opération à cœur battant ou endoprothèse.
- Clampage de l’aorte descendante, lésions d'ischémie-reperfusion.
- Embolisation d’athéromes ou de particules (cathétérisme, manipulation aortique).
- Opération en urgence ou réopération.
- Effets de la CEC:
- Durée de la CEC et du clampage aortique, profondeur de l’hypothermie; la CEC diminue de 20% l'apport d'O2 au parenchyme rénal [33].
- Réchauffement rapide (> 1°C/5 min), gradient de T° > 4°C entre le sang artériel et le sang veineux.
- Réponse inflammatoire systémique (radicaux libres, cytokines, etc) et endotoxines [55].
- Anémie (hémodilution à Ht ≤ 26%); une valeur d'Hb < 100 g/L double le risque de néphropathie aiguë.
- Transfusions érythrocytaires (> 2 unités).
- Hémolyse (hémoglobinurie) et rhabdomyolyse (myoglobinurie).
- Tubulotoxicité du Fe2+ libre généré par hémolyse et par stress oxydatif (ischémie-reperfusion, radicaux libres) [20].
- Utilisation de substances néphrotoxiques:
- Produits de contraste radiologique (coronarographie, angio-CT dans les 5 jours préopératoires).
- Anti-inflammatoires non-stéroïdiens (AINS).
- Inhibiteurs de l’enzyme de conversion et du récepteur de l’angiotensine, metformine.
- Antibiotiques aminoglycosides.
- Inhibiteurs de la calcineurine (tacrolimus, ciclosporine).
- Colloïdes dérivés d’amidon (HES) et aprotinine (substances abandonnées) [29,38].
- Polymorphisme génétique identifiant le risque individuel d'insuffisance rénale postopératoire [57].
| Insuffisance rénale post-CEC |
|
Facteurs étiologiques :
- Néphropathie préopératoire (créatininémie > 200 mcmol/L), facteur le plus important
- Hypovolémie et hypotension (PAM < 70% de sa valeur habituelle pendant > 20 minutes)
- Bas débit de CEC (< 1.8 L/min/m2)
- Apport d'O2 insuffisant (Ht < 26%)
- Longue CEC hypothermique
- Age > 65 ans
- Substances néphrotoxiques
- SIRS, hémolyse, rhabdomyolyse
|
Protection rénale
Une optimisation de l’hémodynamique en per- et en post-opératoire (PAM > 75 mmHg, DC > 2.5 L/min/m2, Ht minimal en CEC > 26%, DO2 > 600 mL/min/m2, SvO2 > 70%) avec une préservation du volume circulant et des inotropes diminue significativement l’incidence de néphropathie (OR 0.64) et la mortalité (OR 0.66) [7]. Le remplacement liquidien selon une administration strictement dirigée par le monitorage hémodynamique (volume systolique, débit cardiaque, SvO2) garantit une meilleure adéquation entre les perfusions et les besoins, à la fois en volume et en synchronisation dans le temps (voir Chapitre 4 Besoins liquidiens) ; il diminue significativement l’incidence de néphropathie aiguë postopératoire, particulièrement chez les patients à haut risque [7].
L’anémie, les transfusions et les reprises pour hémostase sont 3 facteurs prédictifs d’insuffisance rénale parmi les plus importants (OR 1.8-2.9), mais sont aussi parmi ceux qui s’avèrent les plus maîtrisables [30]. La fonction rénale et le taux d'insuffisance rénale postopératoires s'aggravent linéairement lorsque l'Ht s’abaisse en dessous de 30%; cette péjoration est maximale lorsque l’Ht le plus bas est inférieur à 24% [35]. L’incidence de néphropathie aiguë est de 4.1% chez les patients anémiques et de 1.6% chez les patients eucythémiques [31]. La mortalité s'accroît de manière directement liée à l'importance de la lésion rénale. Mais, à valeur similaire d'Ht, les patients transfusés présentent systématiquement une péjoration de leur fonction rénale par rapport à ceux qui ne sont pas transfusés; leur mortalité est plus élevée (3.8% versus 1.4%) et leur incidence d'insuffisance rénale plus importante (12% versus 3.4%) [22]. On est donc placé devant un dilemme troublant: l'anémie aggrave la situation, mais la transfusion, au lieu de la corriger, ajoute un facteur délétère supplémentaire (Figure 7.27). Cette constatation rend encore plus impérative la correction de l'anémie en préopératoire.
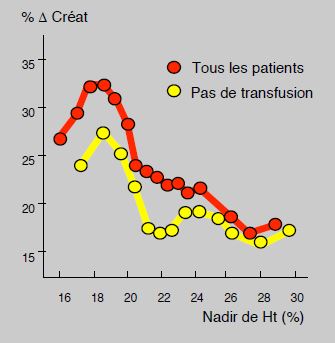
Figure 7.27 : Variation de la créatinine postopératoire en fonction de l'Ht le plus bas. La fonction rénale et le taux d'insuffisance rénale postopératoires s'aggravent linéairement lorsque l'Ht le plus bas est inférieur à 24%. Mais, à valeur similaire d'Ht, les patients transfusés présentent systématiquement une péjoration de leur fonction rénale par rapport à ceux qui ne sont pas transfusés [22].
Certaines substances entretiennent chez les anesthésistes une croyance dans leurs capacités "protectrices" sur la fonction rénale. Cependant, rares sont celles qui semblent avoir un effet bénéfique sur la fonction rénale postopératoire (voir Chapitre 24, Protection rénale) [47].
- Le mannitol est filtré complètement dans les glomérules, et n'est pas résorbé dans les tubules: il augmente le volume plasmatique et la diurèse par augmentation de l'excrétion d'eau et diminution de la réabsorption de sodium; de plus, il a une activité anti-oxydante et s'oppose aux effets des groupes hydroxyles ("radicaux libres") libérés lors de la revascularisation. Les preuves de son efficacité comme agent protecteur contre les effets de l'ischémie rénale sont très pauvres; aucune étude clinique n'a mis en évidence une amélioration quelconque du pronostic de l'insuffisance rénale postopératoire [52]. A raison de 0.5 g/kg dans le liquide d'amorçage de la CEC, il augmente la volémie, la pression capillaire glomérulaire, la pression tubulaire proximale et la diurèse, mais aucun effet bénéfique sur la fonction rénale périopératoire n'a pu être démontré [27]. Il n’est probablement efficace qu’en cas d’hémolyse ou de rhabdomyolyse.
- Le furosémide augmente le FPR et baisse les résistances vasculaires rénales en plus de son effet diurétique. Son utilisation prophylactique diminue clairement l'incidence de l'anurie, mais ne modifie le pronostic de l'insuffisance rénale que dans le sens d'une augmentation non significative du besoin de dialyse [9,34]. En peropératoire, il n'a sa place que pour diminuer l'excès de liquide interstitiel après la CEC (10-20 mg) lorsque le bilan est trop positif comme le prouve la présence d'une hypoxémie ne réagissant pas à la ventilation à 100% O2 avec PEEP. Il est également utile pour contrôler la reprise de la fonction rénale après une reconstruction réno-vasculaire ou une ischémie et reperfusion. Les hautes doses contribuent à l'élimination de l'hémoglobine libre ou de la myoglobine.
- La dopamine à raison de 1-3 mcg/kg/min augmente le FPR, la filtration glomérulaire et la diurèse, mais ne s'est avérée d'aucune incidence sur la fonction rénale postopératoire ni sur le devenir des patients en état critique [4]. Bien qu'elle ait un effet favorable sur la diurèse, aucune étude clinique concluante n'a démontré un quelconque bénéfice à l'utilisation prophylactique de la dopamine dans le cadre de l'insuffisance rénale postopératoire, que la fonction préopératoire soit normale ou altérée [39,46]. Elle n'augmente pas le flux plasmatique rénal cortical en CEC, et ne compense pas la diminution de la perfusion corticale secondaire à la chute de la pression de perfusion en dessous de 70 mmHg [37]. Comme le taux d'arythmies postopératoires est plus élevé en présence de dopamine, la valeur de cette prophylaxie reste à justifier [14]. De plus, elle pourrait être responsable d'une dysfonction tubulaire proximale post-CEC [11].
- Le fenoldopam est un analogue de la dopamine qui stimule sélectivement les récepteurs DA1 et qui induit une augmentation dose-dépendante du FPR et de la diurèse (0.03-0.3 mcg/kg/min) [8]. Il a l'avantage d’augmenter le FPR dans le cortex et dans la médullaire. Il ne cause pas de tachycardie ni d'arythmies, mais il présente un effet hypotenseur marqué car c'est un vasodilatateur artériolaire puissant. L’activité néphro-protectrice d’une perfusion continue (0.1 mcg/kg/min) a été démontrée dans des études récentes, mais n'est pas confirmée par tous les travaux [48,61].
- Le lévosimendan est la seule substance inotrope associée à une baisse du risque de néphropathie aiguë [60].
- Les statines; les données sont contradictoires. Certaines études tendent à montrer une incidence de néphropathie aiguë plus basse chez les patients sous statines avant et après la chirurgie [36,44], mais l'étude la plus récente ne retrouve aucun bénéfice à la rosuvastatine [65]. Comme l'aspirine, les statines diminuent la mortalité postopératoire, mais n'ont probablement pas d'effet sur l'incidence de la néphropathie [10].
- Le préconditionnement par les halogénés: le sevoflurane en CEC diminue les marqueurs de la dysfonction rénale postopératoire comme la cystatine C [28]. Le préconditionnement ischémique à distance (voir Chapitre 24, Protection myocardique) tend à diminuer l'incidence de néphropathie post-CEC [64].
- Les anti-oxydants comme la N-acétylcystéine (Salmucol®) ou l’allopurinol (Xyloric®) diminuent les marqueurs inflammatoires et bloquent l’effet toxique des radicaux libres, mais leur utilisation clinique s’avère décevante et n’apporte pas de bénéfice en terme de mortalité ni de morbidité en chirurgie aortique ou en chirurgie cardiaque avec CEC [51].
- Deux substances présentant des effets anti-inflammatoires et anti-apoptose, la minocycline (tétracycline) et l’EPO, semblent diminuer significativement la proportion de patients développant une néphropathie aiguë après chirurgie cardiaque [19]. Les stéroïdes ont une efficacité douteuse [1].
- L’administration de bicarbonate pour alcaliniser les urines semble pouvoir atténuer la néphropathie postopératoire, notamment par la solubilisation de l’Hb libre liée à l’hémolyse de la CEC et par activation de la chélation du Fe2+ libre [20,21].
Alors que la prophylaxie pharmacologique a un impact aussi variable que contesté, il existe toute une série de mesures techniques dans la prise en charge du malade qui peuvent diminuer l’incidence et la gravité de la néphropathie aiguë [3,42].
- Délai d’au moins 5 jours entre les examens avec produit de contraste et l’opération; la surhydratation pour forcer la diurèse ne présente pas de bénéfice significatif.
- Utillisation d’aspirine et de statines en périopératoire.
- Arrêt des AINS 3 jours avant l’opération, et des IEC pour une durée de 24-48 heures.
- Eviter tous les agents néphrotoxiques (aminoglycosides, vancomycine, etc) ou modifiant le flux plasmatique rénal (IEC, ARA).
- Eviter l’anémie préopératoire (préparation avec du fer et/ou de l’EPO) [31].
- Titration des perfusats cristalloïdes pour maintenir la volémie et l’hémodynamique aussi proches que possible de leurs valeurs normales:
- PAM ≥ 75 mmHg ;
- PAPO 12-15 mmHg, PVC < 10 mmHg;
- Débit urinaire > 0.5 mL/kg/h;
- Ht minimal en CEC > 26%.
- Préférence pour les cristalloïdes plutôt que les HES ou les colloïdes, et pour les solutions tamponnées (Hartmann, Ringer, Plasmalyte) plutôt que le NaCl [40,42]. L'albumine est théoriquement le meilleur expandeur plasmatique, mais elle ne réduit pas l'incidence de NPA [6]; elle n'est indiquée que si sont taux plasmatique est < 40 g/L [40].
- Préférence pour des techniques moins invasives comme l’endoprothèse ou la chirurgie à cœur battant; les pontages aorto-coronariens à cœur battant (OPCAB) réduisent l’incidence de NPA chez les malades à haut risque (OR 0.6) mais probablement pas chez ceux qui ont une fonction rénale normale [45].
- Limiter la durée de la CEC.
- Limiter l’hémorragie peropératoire, éviter l’hémodilution excessive (Ht min 26%) et restreindre le nombre de poches de sang.
- Administration de bicarbonate de Na+ et éventuellement du mannitol en cas d'hémolyse (urine rouge foncé).
Cinq éléments ont une part prépondérante dans la genèse de la néphropathie aiguë postopératoire et sont relativement faciles à gérer lorsqu’ils sont présents pendant une CEC:
- La durée de l'ischémie (temps de clampage);
- Le bas débit de pompe;
- L’hémodilution;
- L'hypovolémie;
- L’hypotension artérielle.
Les deux premières sont du ressort de l'opérateur et du perfusionniste, mais les trois autres sont entre les mains de l'anesthésiste et de l’intensiviste. Le maintien d'un volume circulant normal, d'un transport d'O2 adéquat, d'une pression de perfusion convenable et d’un débit de pompe satisfaisant est donc la clef de la prévention rénale. Toutefois, la relation entre l'hypotension artérielle en CEC et l'incidence de néphropathie aiguë postopératoire est loin d'être claire. Elle s'atténue lorsqu'on exclu tous les facteurs confondants qui sont des causes reconnues d'insuffisance rénale [50].
| Protection rénale |
|
Facteurs primordiaux :
- Normovolémie
- Normotension (PAM 80 mmHg, minimum 70 mmHg en CEC)
- DC ≥ 2.4 L/min/m2 en normothermie, 1.8 L/min/m2 en hypothermie (CEC)
- DO2 normal : Ht minimal > 26% sans transfusions
- Absence d’agents néphrotoxiques
Protection pharmacologique possible : fenoldopam, bicarbonate, statines
Agents inotropes les plus adéquats: dobutamine, milrinone, levosimendan
Sans effet protecteur (bien que ↑ débit urinaire) : dopamine, mannitol, diurétiques de l’anse
La meilleure protection est le maintien dans la normalité de la PAM (≥ 75 mmHg), de la volémie et de l’Hb, tout en évitant l’excès de vasoconstricteurs alpha et de transfusions.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Septembre 2019
Références
- AUGOUSTIDES JGT. The inflammatory response to cardiac surgery with cardiopulmonary bypass : shoud steroid prophylaxis be routine ? J Cardiothorac Vasc Anesth 2012 ; 26 :952-8
- ARONSON S, BLUMENTHAL R. Perioperative renal dysfunction and cardiovascular anesthesia: concerns and controversies. J Cardiothor Vasc Anesth 1998; 12:567-86
- ARORA P, KOLLI H, NAINANI N, et al. Preventable risk factors for acute kidney injury in patients undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2012; 26:687-97
- BELLOMO R, CHAPMAN M, FINFER S, et al. Low-dose dopamine in patients with early renal dysfunction: A placebo controlled randomized trial. Lancet 2000; 356:2139-43
- BIRNIE K, VERHEYDEN V, PAGANO D, et al. Predictive models for kidney disease: improving global outcomes (KDIGO) defined acute kidney injury in UK cardiac surgery. Crit Care 2014; 18:606
- BREZIS M, ROSEN S. Hypoxia of the renal medulla – its implications for disease. N Engl J Med 1995; 332:647-55
- BRIENZA N, GIGLIO MT, MARUCCI M, FIORE T. Does perioperative hemodynamic optimization protect renal function in surgical patients ? A meta-analytic study. Crit Care Med 2009; 37: 2079-90
- BROGDEN RN, MARKHAM A. Fenoldopam: a review of its pharmacodynamic and pharmacokinetics properties and intravenous clinical potential in the management of hypertensive urgencies and emergencies. Drugs 1997; 54:634-50
- BROWN CB, OGG CS, CAMERON JS. High-dose furosemide in acute renal failure: A controlled clinical trial. Clin Nephrol 1991; 15:90-6
- CAO L, YOUNG N, LIU H, et al. Preoperative aspirin use and outcomes in cardiac surgery patients. Ann Surg 2011; 255:399-404
- CARCOANA OV, MATHEW JP, DAVIS E, et al. Mannitol and dopamine in patients undergoing cardiopulmonary bypass: a randomized clinical trial. Anesth Analg 2003; 97:1222-9
- CHENITZ KB, LANE-FALL MB. Decreased urine output and acute kidney injury in the postanesthesia care unit. Anesthesiol Clin 2012; 30:513-26
- CHERTOW GM, BURDICK E, HONOUR M, et al. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J Am Soc Nephrol 2005; 16:3365-70
- CHIOLERO R, BORGEAT A, FISCHER A. Postoperative arrhythmias and risk factors after open heart surgery. J Thorac Cardiovasc Surg 1991; 39:81-4
- COLEMAN MD, SHAEFI S, SLADEN RN. Preventing acute kidney injury after cardiac surgery. Curr Opin Anesthesiol 2011; 24:70-6
- DE GEUS HRH, RONCO C, HAASE M, et al. The cardiac surgery-associated neutrophil gelatinase-associated lipocalin (CSA-NGAL) score: a potential tool to monitor acute tubular damage. J Thorac Cardiovasc Surg 2016; 151:1478-81
- FUHRMAN DY, KELLUM JA. Epidemiology and pathophysiology of cardiac surgery-associated acute kidney injury. Curr Opin Anesthesiol 2017; 30:60-5
- GAFFNEY AM, SLADEN RN. Acute kidney injury in cardiac surgery. Curr Opin Anesthesiol 2015; 28:50-9
- GARWOOD S. Cardiac surgery-associated acute renal injury: New paradigms and innovative therapies. J Cardiothorac Vasc Anesth 2010; 24:990-1001
- HAASE M, BELLOMO R, HAASE-FIELITZ A. Novel biomarkers, oxidative stress, and the role of labile iron toxicity in cardiopulmonary bypass-associated acute kidney injury. J Am Coll Cardiol 2010; 55:2024-33
- HAASE M, HAASE-FIELITZ A, BELLOMO R, et al. Sodium bicarbonate to prevent increases in serum creatinine after cardiac surgery: a pilot double-blind, randomized controlled trial. Crit Care Med 2009; 37:39-47
- HABIB RH, ZACHARIAS A, SCHWANN TA, et al. Role of hemodilutional anemia and transfusion during cardiopulmonary bypass in renal injury after coronary revascularization: Implications on operative outcome. Crit Care Med 2005; 33:1749-56
- HO J, TANGRI N, KOMENDA P, et al. Urinary, plasma, and serum biomarkers' utility for predicting acute kidney injury associated with cardiac surgery in adults: a meta-analysis. Am J Kidney Dis 2015; 66:993-1005
- HORI D, KATZ NM, FINE DM, et al. Defining oliguria during cardiopulmonary bypass and its relationship with cardiac surgery-associated acute kidney injury. Br J Anaesth 2016; 117:733-40
- HOSTE EAJ, VANDENBERGHE W. Epidemiology of cardiac surgery-associated acute kidney injury. Best Pract Res Clin Anesthesiol 2017; 31:299-303
- HU J, CHEN R, LIU S, et al. Global incidence and outcomes of afult patients with acute kidney injury after cardiac surgery: a systematic review and meta-analysis. J Cardiothorac Vasc Anesth 2016; 30:82-9
- IP-YAM PC, MURPHY S, BAINES M, et al. Renal function and proteinuria after cardiopulmonary bypass: The effects of temperature and mannitol. Anesth Analg 1994; 78:842-847
- JULIER K, DA SILVA R, GARCIA C, et al. Preconditioning by sevoflurane decreases biochemical markers for myocardial and renal dysfunction in coronary artery bypass graft surgery. Anesthesiology 2003; 98:1315-27
- KARKOUTI K, BEATTIE WC, DATTILO KM, et al. A propensity score case-control comparison of aprotinin and tranexamic acid in high-transfusion-risk cardiac surgery. Transfusion 2006; 46:327-38
- KARKOUTI K, WIJEYSUNDERA DN, YAU TM, et al. Acute kidney injury after cardiac surgery. Focus on modifiable risk factors. Circulation 2009; 119:495-502
- KARKOUTI K, WIJEYSUNDERA DN, YAU TM, et al. Influence of erythrocyte transfusion on the risk of acute kidney injury after cardiac surgery differs in anemic and non-anemic patients. Anesthesiology 2011; 115:523-30
- KELLUM JA, ASPELIN P, BARSOUM RS, et al. for KDIGO AKI Work Group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int 2012; 2(Suppl):1-138
- LANNEMYR L, BRAGADOTTIR G, KRUMBHOLZ V, et al. Effects of cardiopulmonary bypass on renal perfusion, filtration, and oxygenation in patients undergoing cardiac surgery. Anesthesiology 2017; 126:205-13
- LASSNIGG A, DONNER E, GRUBHOFER G, et al. Lack of renoprotective effects od dopamine and furosemide during cardiac surgery. J Am Soc Nephrol 2000; 11:97-104
- LEVI A, CROMHEECKE ME, DE JONGE E, et al. Blood loss in cardiac surgery: a meta-analysis of clinical relevant endpoints. Lancet 1999; 354:1940-7
- LIAKOPOULOS OJ, CHOI YH, HALDENWANG PL, et al. Impact of preoperative statin therapy on adverse postoperative outcomes in patients undergoing cardiac surgery: A meta-analysis of over 30,000 patients. Eur Heart J 2008; 29:1548:59
- MACKAY JH, FEERICK AE, WOODSON LE, et al. Increasing organ blood flow during cardiopulmonary bypass in pigs: Comparison of dopamine and perfusion pressure. Crit Care Med 1995; 23:1090-8
- MANGANO DT, TUDOR I, DIETZEL C, et al. The risk associated with aprotinin in cardiac surgery. N Engl J Med 2006; 354:353-65
- MARIK PE. Low-dose dopamine: a systematic review. Intens Care Med 2002; 28:877-83
- MÅRTENSSON J, BELLOMO R. Does fluid management affect the occurrence of acute kidney injury ? Curr Opin Anaesthesiol 2017; 30:84-91
- MAZZARELLA V, TACCONE GM, TOZZI C, et al. Renal functions in patients undergoing cardiopulmonary bypass operations. J Thorac Cardiovasc Surg 1992; 104:1625-7
- MEERSCH M, ZARBOCK A. Prevention of cardiac surgery-associated acute kidney injury. Curr Opin Anaesthesiol 2017; 30:76-83
- MEHTA RL, KELLUM JA, SHAH SV, et al. Acute Kidney Injury Network : report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11:R31
- MOLNAR AO, PARIKH CR, COCA SG, et al. Association between preoperative statin use and acute kidney injury biomarkers in cardiac surgical procedures. Ann Thorac Surg 2014; 97:2081-7
- NIGWEKAR SU, KANDULA P, HIX JK, et al. Off-pump coronary artery bypass surgery and acute kidney injury : A meta-analysis of randomized and observational studies. Am J Kidney Dis 2009 ; 54 : 413-23
- O'HARA JF. Low-dose "renal" dopamine. Anesthesiol Clin N Am 2000; 18:835-51
- PATEL NN, ROGERS CA, ANGELINI GD, MURPHY GJ. Pharmacological therapies for the prevention of acute kidney injury following cardiac surgery: a systematic review. Heart Fail Rev 2011; 16:553-67
- RANUCCI M, DE BENEDETTI D, BIANCHINI C, et al. Effects of fenoldopam infusion in complex cardiac surgical operations: a prospective, randomised, double-blind, placebo-controlled study. Minerva Anesthesiol 2010; 76:249-59
- RANUCCI M, ROMITTI F, ISGRO G, et al. Oxygen delivery during cardiopulmonary bypass and acute renal failure after coronary opertaions. Ann Thorac Surg 2005; 80:2213-20
- RETTIG TCD, PEELEN ML, GEUZEBROEK GSC, et al. Impact of intraoperative hypotension during cardiopulmonary bypass on acute kidney injury after coronary artery bypass grafting. J Cardiothorac Vasc Anesth 2017; 31:622-8
- SAGAR UN, KANDULA P. N-acetylcysteine in cardiovascular surgery-associated renal failure: A meta-analysis. Ann Thorac Surg 2009; 87:139-47
- SCHOENWALD PK. Intraoperative management of renal function in the surgical patient at risk. Anesthesiol Clin N Am 2000; 18:719-37
- SETTERGREN G, ÖHQVIST G. Renal dysfunction during cardiac surgery. Curr Opin Anaesthesiol 1994; 7:59-64
- SIMMONS PI, ANDERSON RJ. Increased serum creatinine: A marker for adverse outcome before and after cardiac surgery. Crit care Med 2002; 30:1664-5
- SINCLAIR DG, HASLAM PL, QUINLAN GJ, et al. The effect of cardiopulmonary bypass on intestinal and pulmonary endothelial permeability. Chest 1995; 108:718-24
- SKYTTE LARSSON J, BRAGADOTTIR G, KRUMBHOLZ G, et al. Effects of acute plasma volume expansion on renal perfusion, filtration, and oxygenation after cardiac surgery: a randomized study on crystalloid vs colloid. Br J Anaesth 2015; 115:736-42
- STAFFORD-SMITH M, LI YJ, MATHEW JP, et al. Genome-wide association study of acute kidney injury after coronary bypass graft surgery identifies susceptibility loci. Kidney Int 2015; 88:823-32
- SWAMINATHAN M, STAFFORD-SMITH M. Renal dysfunction after vascular surgery. Curr Opin Anaesthesiol 2003; 16:45-52
- THADHANI R, PASCUAL M, BONVENTRE JV. Acute renal failure. N engl J Med 1996; 334:1448-60
- TOLLER W, HERINGLAKE M, GUARRACINO F, et al. Preoperative and perioperative use of levosimendan in cardiac surgery: European expert opinion. Int J Cardiol 2015; 184:323-36
- TUMLIN JA, FINKEL KW, MURRAY PT, et al. Fenoldopam mesylate in early acute tubular necrosis : a randomized, double-blind, placebo-controlled clinical trial. Am J Kidney Dis 2005 ; 46 :26-34
- URZUA J, TRONCOSCO S, BUGEDO G, et al. Renal function and cardiopulmonary bypass: effect of perfusion pressure. J Cardiothorac Vasc Anaesth 1992; 6:309-12
- YI Q, LI K, JIAN Z, et al. Risk factors for acute kidney injury after cardiovascular surgery: evidence from 2'157 cases and 49'777 controls: a meta-analysis. Cardiorenal Med 2016; 6:237-50
- ZARBOCK A, KELLUM JA, VAN AKEN H, et al. Long-term effects of remote ischemic preconditioning on kidney function in high-risk cardiac surgery patients. Anesthesiology 2017; 126:787-98
- 65 ZHENG Z, JAYARAM R, JIANG L, et al. Perioperative rosuvastatin in cardiac surgery. N Engl J Med 2016; 374:1744-53
