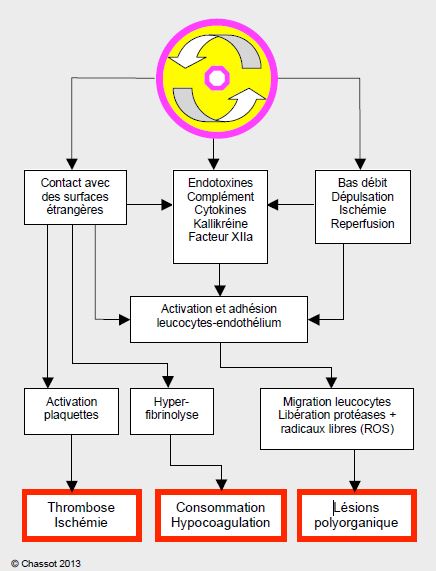
L’inflammation est une réaction de défense de l’organisme contre un envahisseur. C’est un système complexe et redondant, qui comprend de nombreux circuits de rétroaction amplificateurs, mais aussi des circuits inhibiteurs qui en limitent la portée. Dans une plaie, la barrière cutanée ou muqueuse est brisée. Le corps doit à la fois s’y protéger des toxines et y empêcher la perte de sang. C’est la raison pour laquelle la réaction inflammatoire est intimement liée à la coagulation. Normalement, le sang n’est en contact qu’avec l’endothélium vasculaire, avec lequel il entretient un équilibre constant. Lorsqu’il rencontre une surface non-endothélialisée comme une lésion ou un corps étranger, il déclenche toute une cascade de phénomènes protecteurs. Le processus inflammatoire est conçu pour rester localisé, mais il arrive que la réponse soit exagérée ou que l’agression soit systémique, comme c’est le cas lorsque le sang rentre en contact avec des surfaces étrangères dans une CEC. La réaction de défense de l’organisme se transforme alors en un syndrome inflammatoire systémique (Systemic Inflammatory Reaction Syndrome ou SIRS).
En chirurgie cardiaque, le SIRS est déclenché par une série de phénomènes: le contact avec les surfaces du circuit de CEC, le contact avec l’air dans les aspirations de cardiotomie, l'hypothermie, l'héparinisation et les complexes héparine-protamine, l'ischémie et la reperfusion, ou encore les toxines libérées dans le tube digestif. Environ 20% des patients à bas risque développent des complications liées au SIRS [19,25]: coagulopathie, accumulation liquidienne interstitielle (oedème cérébral, péjoration des échanges gazeux), dysfonction multiorganique (troubles neurologiques, insuffisance cardiaque, rénale et hépatique).
La réaction inflammatoire comprend deux phases distinctes liées à des déclencheurs différents [48,54].
- Phase précoce; elle est mise en route par le contact du sang avec une surface non-endothélialisée comme la CEC (voie de contact), et comprend deux composantes intimement imbriquées:
- La voie humorale, qui comprend 3 éléments, la coagulation, le complément et les cytokines;
- La voie cellulaire, constituée par les globules blancs et l’endothélium.
- Phase tardive: elle est liée aux lésions d’ischémie et de reperfusion, et à la libération d’endotoxines, essentiellement par le tube digestif.
Voie humorale
Le complément est le plus ancien moyen de défense de l’organisme, puisqu’on le retrouve déjà chez les oursins. Il consiste en un ensemble de 35 molécules qui assistent la réaction antigène-anticorps ou la défense anti-bactérienne, et qui convergent vers des protéines particulièrement redoutables puisqu’elles sont capables de perforer les membranes cellulaires (MAC : membrane attack complex) [49]. Très imbriquée avec la cascade de la coagulation, la chaîne du complément comprend 3 voies distinctes (classique, alternative et de la lectine) qui convergent vers le clivage du facteur C3 en C3a (anaphylatoxine I, libération d’histamine) et C3b, lequel clive à sont tour le facteur C5 en C5a (anaphylatoxine II, activateur leucocytaire) et C5b qui est le premier composant du complexe MAC (Figure 7.21).
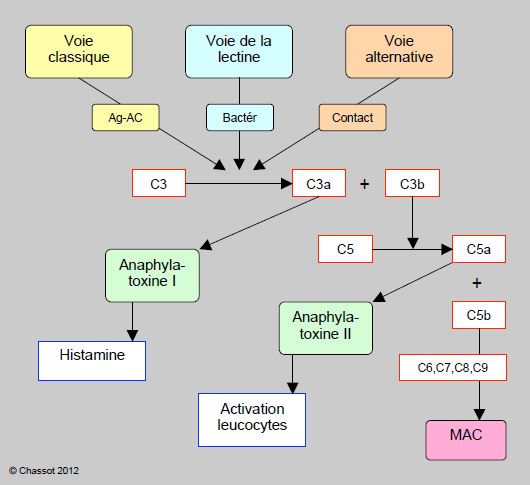
Figure 7.21 : Schéma simplifié de l’activation du complément. La chaîne du complément comprend 3 voies qui sont initiées par des déclencheurs distincts : la voie classique (réaction antigène-anticorps Ag-Ac), la voie alternative (activation directe par contact) et la voie de la lectine (site des membranes bactériennes). Par différentes étapes intermédiaires, elles convergent vers le clivage du facteur C3 en C3a (anaphylatoxine I, libération d’histamine) et C3b, lequel clive à sont tour le facteur C5 en C5a (anaphylatoxine II, activateur leucocytaire) et C5b qui est le premier composant du complexe MAC (MAC : membrane attack complex), complexe protéique qui attaque les membranes cellulaires et qui est le résultat ultime des voies du complément. Les nombreuses étapes intermédiaires ne sont pas représentées ici.
Le système kinine-kallikréine comprend un groupe de protéines sériques impliquées dans la régulation du tonus et de la perméabilité vasculaires. Elles circulent sous forme de kininogènes inactives, qui sont activées par les kallikréines libérées dans les tissus lésés. Cette réaction donne naissance à la bradykinine qui est vasodilatatrice (sécrétion de NO et de prostacycline). Il existe une kallikréine plasmatique qui circule sous forme de prékallikréine inactive et qui est activée par le Facteur XIIa de la coagulation (facteur Hageman ou facteur de contact). Comme la bradykinine formée est elle-même un activateur du Facteur XII, il se forme ici un système auto-amplificateur du lien avec la cascade de la coagulation.
Les cytokines sont des polypeptides qui assurent la communication entre cellules et déclenchent des activités spécifiques selon leurs cibles [48].
- TNF-alpha (Tumor necrosis factor); sécrété par les monocytes, les mastocytes et les lymphocytes-T en réponse aux endotoxines bactériennes, il active la chaîne inflammatoire. A haute concentration, il provoque une symptomatologie de choc septique avec des effets cardiodépresseur, vasodilatateur, thrombogène et perméabilisant capillaire.
- Interleukines pro-inflammatoires (IL-1, IL-6, IL-8); sécrétées par les leucocytes, elles activent la production de protéine C-réactive, de fibrinogène et de catécholamines; elle provoquent une hyperglycémie, une leucocytose et de la fièvre.
- Interleukines anti-inflammatoires (IL-10); elles assurent un feed-back négatif qui empêche l’emballement de ces réactions en chaîne.
La cascade de la coagulation (voir Figure 7.20) est intimement connectée à la réaction inflammatoire. La thrombine, par exemple, en potentialise plusieurs effets: activation des polymorphonucléaires et des plaquettes, sécrétion l’IL-6 et d’IL-8, activation de C3. De leur côté, les plaquettes stimulent l’adhésion des leucocytes à la paroi vasculaire. Malgré l'héparinisation, la production de thrombine continue et entretient une coagulopathie de consommation [25].
Voie cellulaire
Les neutrophiles polymorphonucléaires chargés de phagocyter les pathogènes contiennent des granules pouvant libérer des enzymes protéolytiques, des radicaux oxygénés et des médiateurs inflammatoires. Lorsque survient une lésion vasculaire, ils roulent d’abord à la surface de l’endothélium par l’accrochage de molécules appelées sélectines, puis ils adhèrent à l’endothélium lésé par l’ancrage de molécules appelées intégrines (molécules d’adhésion). En troisième lieu, ils migrent dans l’espace interstitiel par chimiotactisme pour y libérer leurs substances bactéricides [45].
Les basophiles, activés par la voie du complément, sécrètent essentiellement de l’histamine, qui augmente la perméabilité capillaire et facilite le passage des éléments figurés; elle provoque aussi une vasodilatation et une bronchoconstriction. Les mastocytes ressemblent aux basophiles mais sont cantonnés dans l’espace périvasculaire des organes et ne circulent pas; lorsqu’ils sont stimulés par le complément ou la thrombine, ils sécrètent différents médiateurs inflammatoires dont de nombreuses interleukines. Les monocytes, enfin, sont des macrophages qui libèrent une série de facteurs inflammatoires (interleukines, TNF-alpha) et phagocytent les éléments étrangers [48].
Les cellules endothéliales sont les régulatrices naturelles de la coagulation et de l’inflammation. Elles répondent à la présence de thrombine, de facteur C5a, de cytokines et d’interleukines par la sécrétion de sélectines et d’intégrines qui immobilisant les macrophages. Elles gèrent le tonus vasculaires par la libération de substances vasodilatatrices comme le NO, l’histamine et la bradykinine ou de substances vasoconstrictrices comme l’endothéline-1 ou la noradrénaline; par ailleurs, le NO inhibe la fonction plaquettaire.
Outre les leucocytes, la CEC active également les thrombocytes, qui vont sécréter des facteurs de coagulation, des cytokines et des molécules d'adhésion aux parois [25].
Phase tardive
La phase tardive comprend deux composantes.
- Les lésions d’ischémie et de reperfusion. Après avoir été privée d’O2 pendant l’ischémie, la cellule en reçoit en masse au moment de la reperfusion, ce qui déclenche une cascade d'évènements pathologiques plus graves que ne l’étaient les dégâts de l’ischémie, notamment par la formation massive de peroxydes (radicaux libres, ROS reactive oxygen species) qui contiennent un nombre impair d'électrons sur leur orbite externe: peroxide (O2•-), H2O2, hydroxyl (•OH) (voir Chapitre 24, Ischémie et reperfusion). Les peroxydes libérés lors d'activation leucocytaire ou lors de reperfusion après ischémie déclenchent une réaction inflammatoire majeure. Normalement réduits par des antioxydants naturels (superoxide dismutase, catalase, glutathion, vitamine E), ils débordent dans le liquide extracellulaire lorsqu'ils sont produits en masse et attaquent les phospholipides des membranes, le DNA et les protéines [12,15].
- Les endotoxines stimulent massivement la production de complément, de TNF-alpha et d’interleukines. La libération d'endotoxines par les bactéries Gram-négatives qui hantent le tube digestif est liée à la baisse de débit splanchnique en CEC et en hypothermie; le flux dans la muqueuse gastrique, par exemple, est diminué jusqu'à 60% par le bas débit et par la vasoconstriction [38].
La réponse inflammatoire globale conduit à des dysfonctionnements multiples des différents organes: SDRA, insuffisance rénale ou hépatique.
Cas particulier : la CEC
La CEC est le cas le plus emblématique de la stimulation par la voie de contact. En présence de surfaces chargées négativement comme le verre, les métaux ou les plastiques, le Facteur XII se clive en F XIIa (activé). Celui-ci transforme la prékallikréine en kallikréine, les kininogènes en bradykinine et le facteur XI en F XIa; ce dernier processus aboutit à la formation de thrombine par la voie intrinsèque de la coagulation. Le F XIIa favorise aussi la transformation de plasminogène en plasmine, provoquant la fibrinolyse. Le contact active directement le complément par la voie alternative, et indirectement par le F XIIa (voie classique). D’autres phénomènes de la CEC concourent au déclenchement du complément, comme le relargage d’endotoxines et la formation de complexes héparine-protamine. La voie cellulaire est également stimulée par le contact, soit par l’intermédiaire du facteur XIIa et de la kallikréine, soit directement par l’activation des neutrophiles. Mais le circuit extracoroprel ne possède pas d’endothélium pour limiter ces différentes réactions, qui peuvent donc prendre une ampleur excessive et se distribuer dans tout l’organisme (Figure 7.22).
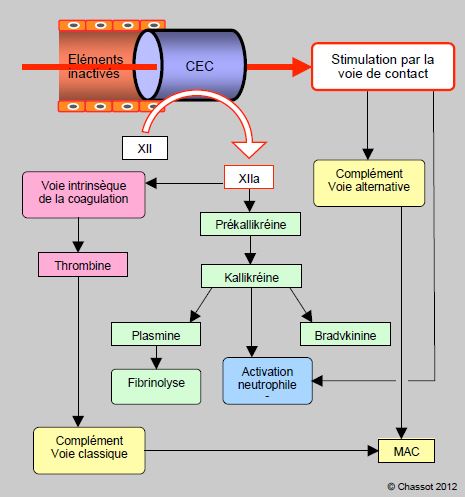
Figure 7.22 : Activation par la voie de contact. Dans un vaisseau bordé d’endothélium intact, les différents facteurs circulent sous forme inactive. Mais en présence de surfaces chargées négativement comme le verre, les métaux ou les plastiques (CEC), le Facteur XII se clive en F XIIa (activé). Celui-ci transforme la prékallikréine en kallikréine, les kininogènes en bradykinine et le facteur XI en F XIa ; ce dernier processus aboutit à la formation de thrombine par la voie intrinsèque de la coagulation. Le F XIIa favorise aussi la transformation de plasminogène en plasmine, provoquant la fibrinolyse. Le contact active directement le complément par la voie alternative, et indirectement par le F XIIa (voie classique). MAC (membrane attack complex): complexe protéique qui attaque les membranes cellulaires, résultat ultime des voies du complément.
La durée de CEC, la profondeur de l'hypothermie, le degré d'hémodilution et les facteurs génétiques ont tous été évoqués comme éléments aggravants, mais ils ne paraissent avoir qu'un rôle secondaire dans la genèse du SIRS [22]. Les lésions mécaniques de la pompe, de l'oxygénateur et des filtres, le contact du sang avec les surfaces étrangères (circuits) et avec l'air (aspirations, réservoir veineux), sont les éléments déclencheurs principaux. Plus de 50% des neutrophiles sont séquestrés dans les poumons durant le réchauffement; leur dégranulation contribue aux dommages cellulaires pulmonaires. Le SIRS se déclenche dans les premières minutes de la CEC et s’éteint vers le 4ème – 5ème jour postopératoire; il est suivi d’une période de relative immunodépression [41]. Le pic des marqueurs inflammatoires survient vers la 5ème heure après la CEC [12].
Au cours d’une CEC, la stimulation inflammatoire conduit donc à un état instable caractérisé par une série de phénomènes (Figure 7.23).
- Elévation de tous les marqueurs inflammatoires (TNF-alpha, interleukines, cytokines, protéine C-réactive);
- Activation du complément et des leucocytes;
- Production de thrombine et stimulation de la cascade de la coagulation;
- Production de plasmine et stimulation de la fibrinolyse (élévation des D-dimères);
- Activation et consommation des plaquettes;
- Relargage d’endotoxines et de TNF-alpha;
- Relargage de radicaux libres et d’oxydants;
- Libération de bradykinine, d’histamine et d’anaphylatoxines: augmentation de la perméabilité capillaire, vasodilatation systémique, vasoconstriction pulmonaire;
- Altérations de la fonction cardiaque, pulmonaire, rénale et cérébrale; l’incidence de fibrillation auriculaire est proportionnelle à l’élévation des marqueurs inflammatoires [14].
La question de déterminer la part de la CEC par rapport à celle de la chirurgie cardiaque elle-même dans la genèse du SIRS peut être approchée par l'observation de la chirurgie à coeur battant. Cette dernière est associée à une réduction, mais pas à une disparition, des taux postopératoires de marqueurs de la réaction inflammatoire comme le C3a, le C5a, le TNF-alpha ou l'interleukine-6 et -8 [8,9,18]. Toutefois, la signification de ces variations est incertaine, puisque l'IL-8 et le C3a sont liés au traumatisme tissulaire direct et que l'IL-10 a des propriétés anti-inflammatoires [34]. Les effets de la CEC dépendent largement de l'équilibre entre la libération des médiateurs pro-inflammatoires et celle des médiateurs anti-inflammatoires [26]. Certaines populations affichent une réaction pro-inflammatoire dominante, telles les personnes âgées ou celles qui souffrent de dysfonction ventriculaire gauche [44]. Elles pourraient bénéficier particulièrement de la chirurgie à coeur battant. Dans les groupes à risque faible, les taux de complications liés au SIRS sont identiques entre les opérations avec ou sans CEC [36,40]. Le circuit de CEC est donc un facteur déclenchant majeur, mais il n'est pas le seul responsable de la réaction inflammatoire [52].
Améliorations techniques
A part les interventions à cœur battant, il existe divers moyens techniques de réduire le syndrome inflammatoire déclenché par la CEC et la chirurgie, mais aucun ne permet de le supprimer. La portée clinique de ces améliorations reste en général modeste [30,55].
- Restriction des aspirations; le sang récupéré contient de l'air, des débris celulaires et des activateurs de la coagulation (TNF, thrombine, plasmine) ou de l’inflammation (interleukines, C3a, C5a). Les aspirations sont la source principale d’embolie, d'hémolyse, de thrombopénie, de coagulopathie et de stimulation du SIRS [47]. Les perturbations du système coagulatoire sont nettement diminuées lorsqu’on ne recycle pas le sang aspiré ou lorsqu’on le filtre dans un système CellSaver™, mais ces manoeuvres éliminent malheureusement les plaquettes, les protéines et les facteurs de coagulation [53].
- Restriction de la taille des circuits; la miniaturisation des circuits et la suppression du réservoir de cardiotomie (MECC: mini-extracorporeal circuit) minimisent le contact du sang avec des surfaces étrangères et suppriment le contact avec l’air, ce qui freine la libération des activateurs de la coagulation et des déclencheurs inflammatoires (voir Mini-CEC) [3,58].
- Biocompatibilité des circuits; les circuits préhéparinés et les circuits imprégnés de polymères comme le poly-2-méthoxy-éthyl-acrylate freinent la cascade du complément et l'activation leucocytaire, réduisent l'adhésivité plaquettaire et l'adsorption des facteurs de coagulation [20]. Même s’ils atténuent les complications pulmonaires, rénales et neurologiques, leur impact clinique est peu important [32,50].
- Hémofiltration; elle réduit l’excédent liquidien propre à la CEC et évacue les déclencheurs inflammatoires hydrosolubles. Elle réduit l’œdème interstitiel postopératoire, les besoins transfusionnels, le syndrome inflammatoire systémique et l’insuffisance multi-organique [5,7,29,42].
- Filtres leucocytaires; la réduction du taux de leucocytes est bénéfique surtout pour les échanges gazeux, puisque les poumons sont le principal lieu de séquestration leucocytaire pendant la CEC. Malheureusement, ces filtres ne préviennent pas l’insuffisance respiratoire postopératoire [2].
- Normothermie; le maintien de la température ≥ 34°C évite les altérations de la coagulation et la flambée inflammatoire déclenchées par le réchauffement, mais la température idéale pour la CEC n’a pas encore pu être définie [37,43].
Ces améliorations ont probablement un impact sur les complications postopératoires dans les cas à haut risque ou les interventions complexes, mais ont peu d'influence pour les interventions standards chez des patients à risque faible à modéré. Vu l'augmentation de prix qu’elles impliquent, ces nouvelles technologies ne présentent pas pour l'instant un rapport coût / bénéfice favorable à leur utilisation de routine. La normothermie, qui ne coûte rien,
Stéroïdes
Les corticostéroïdes maintiennent l’intégrité des membranes cellulaires, particulièrement dans le cœur et les poumons, freinent l’adhésion leucocytaire et réduisent la production de complément et de cytokines [23,54,55]. En dépit d’une nette atténuation de la réaction inflammatoire et d’une claire diminution des marqueurs inflammatoires après CEC, ils ne préviennent les dysfonctions multiorganiques que chez les malades en hypocorticisme, et leur impact clinique demeure incertain. Diverses revues et méta-analyses ont synthétisé les résultats acquis jusqu’ici avec les stéroïdes [1,6,35,56].
- La réduction de l’incidence de FA est significative, mais cet effet n'apparait que dans les études portant sur de petites populations [11].
- Le temps de séjour aux soins intensifs et le temps de séjour hospitalier sont diminués.
- La stabilité hémodynamique peropératoire est améliorée, l’utilisation de vasopresseur est réduite.
- La réduction du taux d’hémorragie est marginale.
- La durée de ventilation mécanique est un peu raccourcie; certaines études ont montré une atténuation des complications respiratoires, mais d’autres publications montrent une aggravation des échanges gazeux postopératoires et un retard à l'extubation.
- Le réveil est amélioré: le taux de nausée, vomissement et frisson est diminué.
- Le taux d’infection de plaie est identique, et le taux d’infections générales peu modifié.
- Le taux d’épisodes hyperglycémiques est augmenté 1.5 fois dans une méta-analyse et celui d’hémorragies digestives est doublé dans une autre.
- La mortalité n’est pas modifiée.
Bien que les protocoles des différentes études soient très variables, on peut en conclure que l’administration prophylactique de stéroïdes pourrait diminuer la morbidité postopératoire, pour autant qu’elle ne soit pas elle-même la cause d’un accroissement des infections et des hémorragies [1]. Les dosages traditionnels étant assez élevés (méthylprednisolone 30 mg/kg, dexaméthasone 1 mg/kg), il est possible que des doses plus faibles aient un meilleur rapport bénétice/complication tout en conservant une activité satisfaisante sur la réduction de la réponse inflammatoire [35].
La question de savoir si une prophylaxie de routine avec des stéroïdes est recommandable a reçu une réponse plutôt négative de deux essais contrôlés et randomisés. Le premier est une étude hollandaise (DECS, DExamethasone for Cardiac Surgery) de 4'494 patients randomisés entre dexaméthasone 1 mg/kg et placebo, administrés à l’induction de l’anesthésie [10]. La mortalité et les complications majeures (infarctus, ictus, insuffisance rénale) sont moindres dans le groupe stéroïde, mais de manière marginale (OR 0.83), alors que d’autres morbidités sont significativement diminuées: infections (OR 0.64), délire (OR 0.79), insuffisance respiratoire (OR 0.69). Les patients à risque élevé (EuroSCORE > 5) tirent le maximum de bénéfice (OR 0.77). Bien que ces résultats ne soient pas renversants, cet essai a clairement démontré l’inocuité du traitement, qui n’a déclenché aucune aggravation du risque hémorragique ni infectieux. Le second essai est une étude multicentrique (SIRS, Steroids In caRdiac Surgery) de 7'507 patients assignés à recevoir 500 mg de méthylprednisolone ou un placebo [57]. La mortalité n'est pas réduite de manière significative (OR 0.87), le taux de complications majeures est inchangé (OR 1.03) et le taux d'infection n'est pas modifié, de même que l'incidence de delirium. Ces deux études, méthodologiquement incontestables, n'incitent donc pas à l'utilisation de stéroïdes comme routine pour diminuer le taux de complications liées la réaction inflammatoire de la CEC.
Autres substances
Les antifibrinolytiques se fixent sur la lysine du plasminogène et bloquent l'activation de la plasmine, donc la fibrinolyse. En clinique, ils diminuent globalement les pertes sanguines de 30%. Trois substances sont utilisées à cet effet (voir Antifibrinolytiques).
- L’aprotinine est un inhibiteur non spécifique de nombreuses protéases qui bloque directement la plasmine; elle inhibe la production de complément, de TNF et de kallikréine [26]. Elle a été retirée du marché en novembre 2007 à cause d’un excès d’insuffisance rénale, de complications cardiaques et de mortalité, bien qu’elle ait été plus efficace que les deux autres substances pour diminuer le risque hémorragique et le taux de transfusion [13,31].
- L’acide tranexamique ne déclenche pas de réactions allergiques ni de dysfonction rénale, mais les hautes doses accroissent le risque de convulsions postopératoires [24,33]. Bien qu’il diminue efficacement le risque hémorragique, il a peu d’effet anti-inflammatoire.
- L’acide ε-aminocaproïque est légèrement moins efficace [24].
Toute une panoplie de substances pharmacologiques est potentiellement utile pour atténuer le syndrome inflammatoire, sans qu’on puisse démontrer pour autant que son impact clinique soit significatif.
- Inhibition du complément: le pexelizumab et le TP10, qui inhibent la chaîne du complément au niveau de C5a, atténuent la morbi-mortalité après chirurgie cardiaque dans des groupes sélectionnés de patients, sans pour l’instant faire preuve d’effets cliniques significatifs [49].
- Antioxydants: la N-acétylcystéine pourrait améliorer les fonctions pulmonaires postopératoires [16]; l'acide ascorbique, l'alpha-tocoférol et l'allopurinol détoxifient les radicaux libres, mais les études cliniques n’ont pas décelé de bénéfice important [17].
- Pentoxifyline (analogue de la théophylline): elle freine les médiateurs et la cascade du complément, et semble améliorer la ventilation postopératoire [4].
- Les statines ont un effet anti-inflammatoire et diminuent la mortalité après pontages aorto-coronariens [59].
- Le bleu de méthylène est un anti-NO et de ce fait possède un effet anti-inflammatoire, mais son usage est réservé aux situations d’hypotension réfractaire [27].
- L’insuline; l’hyperglycémie est accompagnée d’une hypersécrétion de cytokines, et les diabétiques sont connus pour une production excessive de superoxide par leurs mitochondries. De ce fait, le maintien d’une normoglycémie atténue la réaction inflammatoire, mais cette dernière induit une résistance à l’insuline qui peut expliquer les difficultés rencontrées dans la gestion de la glycémie peropératoire [46].
- Divers agents ont un certain effet anti-inflammatoire: milrinone, nitroprussiate, morphine, héparine, IEC [55].
Aspects anesthésiques
L’anesthésiste peut influencer la réaction inflammatoire de plusieurs manières [21].
- Ventilation: la baisse du volume courant à 4-8 mL/kg au lieu de 10-12 mL/kg, la limitation de la Pplateau à < 30 cm H2O, la diminution de la FiO2 à 0.3-0.6 et les manœuvres de recrutement aux 30 minutes limitent les lésions mécaniques et cellulaires, et abaissent les taux de cytokines libérées par les poumons [28].
- Stabilité hémodynamique: l’hypoperfusion tissulaire (hypotension et bas débit) active la libération de cytokines et d’endotoxines, en particulier dans le tube digestif.
- Préconditionnement: les halogénés ont la propriété de diminuer l’impact des lésions ischémiques sur la cellule myocardique, au moins momentanément (voir Chapitre 5 Conditionnement) [39]. Le préconditionnement à distance par courtes périodes d’ischémie musculaire d’un membre a un effet protecteur sur le myocarde et sur la survie clinique [51].
| Réaction inflammatoire systémique |
|
La réaction inflammatoire est un système rapide, complexe et redondant qui sert à la protection de l’organisme contre des agresseurs. Elle comprend une voie humorale (complément, cytokines, kinines), une voie cellulaire (leucocytes, endothélium) et une phase tardive (lésion d’ischémie-reperfusion, relargage d’endotoxines). Elle est très imbriquée avec la cascade de la coagulation.
Le contact direct du sang avec le circuit de CEC et avec l’air induit une réaction inflammatoire systémique (SIRS) massive déclenchée par l’activation du Facteur XII (Hageman), du complément et des leucocytes. Elle est caractérisée par :
- Elévation de tous les marqueurs inflammatoires
- Activation du complément et des leucocytes
- Production de thrombine et stimulation de la cascade de la coagulation
- Production de plasmine et stimulation de la fibrinolyse
- Activation et consommation des plaquettes
- Relargage d’endotoxines, de TNF-alpha et d’interleukines
- Relargage de radicaux libres et d’oxydants
- Libération de bradykinine, d’histamine et d’anaphylatoxines
- Augmentation de perméabilité capillaire, baisse des RAS, augmentation des RAP
- Altérations de la fonction cardiaque, pulmonaire, rénale et cérébrale
Les possibilités thérapeutiques sont nombreuses, mais elles n’ont d’impact clinique que dans les cas à haut risque :
- Restriction du contact avec les surfaces étrangères (minicircuits, matériaux biocompatibles)
- Restriction du contact avec l’air (limitation des aspirations, absence de réservoir veineux)
- Hémofiltration
- Antifibrinolytiques
- Corticostéroïdes
- Antioxydants, inhibiteurs du complément
- Opération sans CEC
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- AUGOUSTIDES JGT. The inflammatory response to cardiac surgery with cardiopulmonary bypass : shoud steroid prophylaxis be routine ? J Cardiothorac Vasc Anesth 2012 ; 26 :952-8
- ASIMAKOPOULOS G. The inflammatory response to CPB: the role of leucocyte filtration. Perfusion 2002; 17:7-10
- BIANCARI F, RIMPILAINEN R. Meta-analysis of randomised trials comparing the effectiveness of miniaturised versus conventional cardiopulmonary bypass in adult cardiac surgery. Heart 2009; 95:964-9
- BOLDT J, BROSCH C, LEHMANN A, et al. Prophylactic use of pentoxifylline on inflammation in elderly cardiac surgery patients. Ann Thorac Surg 2001; 71:1524-9
- BOODHWANI M, WILLIAMS K, BABAEV A, et al. Ultrafiltration reduces blood transfusion following cardiac surgery: a meta-analysis. Eur J Cardiothorac Surg 2006; 30:892-7
- CAPPABIANCA G, ROTUNNO C, DE LUCA TUPPUTI L, et al. Protective effects of steroids in cardiac surgery: A meta-analysis of randomized double-blind trials. J Cardiothorac Vasc Anesth 2011; 25:156-65
- CHEW MS, BRIX-CHRISTENSEN V, RAVN HB, et al. Effect of modified ultrafiltration on the inflammatory response in paediatric open-heart surgery: a prospective, randomized study. Perfusion 2002; 17:327-33
- CZERNY M, BAUMER H, KILO J, et al. Inflammatory response and myocardial injury following coronary artery bypass grafting with or without cardiopulmonary bypass. Eur J Cardiothorac Surg 2000; 17: 737-42
- DIEGELER A, DOLL N, RAUCH T, et al. Humoral immune response during coronary artery bypass grafting: A comparison of limited approach, "off-pump" technique, and conventional cardiopulmonary bypass. Circulation 2000; 102: III95-100
- DIELMAN JM, NIERICH AP, ROSSEEL PM, et al. Intraoperative high-dose dexamethasone in cardiac surgery :a randomized controlled trial. JAMA 2012 ; 308 :1761-7
- DVIRNIK N, BELLEY-COTE EP, HANIF H, et al. Steroids in cardiac surgery: a systematic review and meta-analysis. Br J Anaesth 2018; 120:657-67
- ELAHI MM, YII M, MATATA BM. Significance of oxidants and inflammatory mediators in blood of patients undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2008; 22:455-67
- FERGUSSON DA, HEBERT PC, MAZER CD, et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery. N Engl J Med 2008; 358:2319-31
- FONTES ML, MATHEW JP, RINDER HM, et al. Atrial fibrillation after cardiopulmonary bypass is associated with monocyte activation. Anesth Analg 2005; 101:17-23
- FRÄSSDORF J, DE HERT S, SCHLACK W. Anaesthesia and myocardial ischaemia/reperfusion injury. Br J Anaesth 2009; 103:89-98
- FRUMENTO RJ, LEE D, OZ MC, et al. N-acetylcysteine and total antioxydant status in high-risk cardiac surgical patients. Anesth Analg 2002; 93:SCA16
- GIRARD C. CEC et inflammation. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris, Arnette Groupe Liaison SA, 2004, pp 147-55
- GORMLEY SMC, McBRIDE WT, ARMSTRONG MA, et al. Plasma and urinary cytokine homeostasis and renal function during cardiac surgery without cardiopulmonary bypass. Cytokine 2002; 17:61-5
- GROVER FL. The Society of thoracic Surgeons national Database. Current status and future directions. Ann Thorac Surg 1999; 68:367-73
- GUNAYDIN S, FARSAK B, KOKAKULAK M, et al. Clinical performance and biocompatibility of poly(2-methoxyethylacrylate)-coated extracorporeal circuits. Ann Thorac Surg 2002; 74:819-24
- HALL R. Identification of inflammatory mediators and their modulation by strategies for the management of the Systemic Inflammatory Response during cardiac surgery. J Cardiothorac Vasc Anesth 2013 ; 27 : 983-1033
- HENNEIN HA. Inflammation after cardiopulmonary bypass: therapy for the postpump syndrome. Semin Cardiothorac Vasc Anesth 2001; 5:236-55
- KILGER E, WEISS F, BRIEGEL J, et al. Stress doses of hydrocortisone reduce severe systemic inflammatory response syndrome and improve early outcome in a risk group of patients after cardiac surgery. Crit Care Med 2003; 31:1068-74
- KOSTER A, SCHIRMER U. Re-evaluation of the role of antifibrinolytic therapy with lysine analogs during cardiac surgery in the post aprotinin era. Curr Opin Anaesthesiol 2011; 24:92-7
- KRAFT F, SCHMIDT C, VAN AKEN H, ZARBOCK A. Inflammatory response and extracorporeal circulation. Best Pract Res Clin Anaesthesiol 2015; 29:113-23
- LAFFEY JG, BOYLAN JF, CHENG DC. The systemic inflammatory response to cardiac surgery: implications for the anesthesiologist. Anesthesiology 2002; 97: 215-52
- LAVIGNE D, Vasopressin and methylene blue: alternate therapies in vasodilatory shock. Semin Cardiothorac Vasc Anesth 2010; 14:186-9
- LELLOUCHE F, DELORME M, BUSSIÈRES J, OUATTARA A. Perioperative ventilatory strategies in cardiac surgery. Best Pract Res Clin Anaesthesiol 2015; 29:381-95
- LUCIANI GB, MENON T, VECCHI B, et al. Modified ultrafiltration reduces morbidity after adult cardiac operations: a prospective randomized clinical study. Circulation 2001: 104:1253-9
- MAHARAJ C, LAFFEY JG. New strategies to control the inflammatory response in cardiac surgery. Curr Opin Anesthesiol 2004; 17:35-48
- MANGANO DT, TUDOR I, DIETZEL C, et al. The risk associated with aprotinin in cardiac surgery. N Engl J Med 2006; 354:353-65
- MANGOUSH O, PURKAYASTHA S, HAJ-YAHIA S, et al. Heparin-bonded circuits versus nonheparin-bonded circuits: an evaluation of their effect on clinical outcomes. Eur J Cardiothorac Surg 2007; 31:1058-69
- MARTIN K, WIESNER G, BREUER T, et al. The risks of aprotinin and tranexamic acid in cardiac surgery: A one-year follow-up of 1188 consecutive patients. Anesth Analg 2008; 107:1783-90
- MENASCHE P. The systemic factor: the comparative roles of cardiopulmonary bypass and off-pump surgery in the genesis of patient injury during and following cardiac surgery. Ann Thorac Surg 2001; 72: S2260-5; discussion S5-6
- MURPHY GS, WHITLOCK RP, GUTSCHE JT, et al. Steroids for adult cardiac surgery with cardiopulmonary bypass : update on dose and key randomized trials. J Cardiothorac Vasc Anesth 2013 ; 27 :1053-9
- NATHOE HM, VAN DIJK D, JANSEN EWL, et al. A comparison of on-pump and off-pump coronary bypass surgery in low-risk patients. N Engl J Med 2003; 348:394-402
- OHATA T, SAWA Y, KADOBA K, et al. Effect of cardiopulmonary bypass under tepid temperature on inflammatory reactions. Ann Thorac Surg 1997; 64:124-8
- OPAL SM. The host response to endotoxin, antipolysaccharide strategies, and the management of severe sepsis. Int J Med Microbiol 2007; 297:365-77
- PAGEL PS. Myocardial protection by volatile anesthetics in patients undergoing cardiac surgery : a critical review of the laboratory and clinical evidence. J Cardiothorac Vasc Anesth 2013 ; 27 :972-82
- PUSKAS JD, WILLIAMS WH, DUKE PG, et al. Off-pump coronary artery bypass grafting provides complete revascularization with reduced myocardial injury, transfusion requirements, and length of stay: A prospective randomized comparison of two-hundred unselected patients undergoing off-pump versus conventional coronary artery bypass surgery. J Thorac Cardiovasc Surg 2003; 125:797-808
- RINDER C. Cellular inflammatory response and clinical outcome in cardiac surgery. Curr Opin Anaesthesiol 2006; 19:65-8
- SEARLES B, DARLING E. Ultrafiltration in cardiac surhery. In: MONGERO LB, BECK JR (eds). On bypass. Advanced perfusion techniques. Totowa (NJ, USA): Humana Press 2010, 193-210
- SHANN KG, LIKOSKY DS, MURKIN JM, et al. An evidence-based review of the practice of cardiopulmonary bypass in adults: A focus on neurologic injury, glycemic control, hemodilution, and the inflammatory response. J Thorac Cardiovasc Surg 2006; 132:283-90
- SHARONY R, BIZEKIS CS, KANCHUGER M, et al. Off-pump coronary artery bypass grafting reduces mortality and stroke in patients with atheromatous aortas: A case control study. Circulation 2003; 108 (suppl II):15-20
- SHERWOOD ER, TOLIVER-KINSKY T. Mechanisms of the inflammatory response. Best Pract Res Clin Anaesthesiol 2004; 18:385-405
- SMITH JW, ROMIJN JA. Acute insulin resistance in myocardial ischemia : causes and consequences. Semin Cardiothorac Vasc Anesth 2006 ; 10 :215-9
- SNIECINSKI RM, CHANDLER WL. Activation of the hemostatic system during cardiopulmonary bypass. Anesth Analg 2011; 113:1319-33
- SNIECINSKI RM, LEVY JH. The inflammatory response to cardiopulmnary bypass. In: MONGERO LB, BECK JR (eds). On bypass. Advanced perfusion techniques. Totowa (NJ, USA): Humana Press 2010, 125-140
- STAHL GL, SHERMAN SK, SMITH PK, LEVY JH. Complement activation and cardiac surgery : a novel target for improving outcomes. Anesth Analg 2012 ; 115 :759-71
- SVENMARKER S, HAGGMARK S, JANSSON E, et al. Use of heprin-bonded circuits in cardiopulmonary bypass improves clinical outcome. Scand Cardiovasc J 2002; 36:241-6
- THIELMANN M, KOTTENBERG E, KLEINBONGARD P, et al. Cardioprotective and prognostic effects of remote ischaemic preconditioning in patients undergoing coronary artery bypass surgery : a single-centre randomised, double-blind, controlled trial. Lancet 2013 ; 382 :597-604
- UNTCH BR, JESKE WP, SCHWARTZ J, et al. Inflammatory and hemostatic activation in patients undergoing off-pump coronary artery bypass grafting. Clin Appl Thromb Hemost 2008; 14-141-8
- WANG G, BAINBRIDGE D, MARTIN J, et al. The efficacy of an intraoperative cell saver during cardiac surgery: a meta-analysis of randomized trials. Anesth Analg 2009; 109:320-30
- WARREN OJ, SMITH AJ, ALEXIOU C, et al. The inflammatory response to cardiopulmonary bypass: Part 1 – Mechanisms of pathogenesis. J Cardiothorac Vasc Anesth 2009; 23: 223-31
- WARREN OJ, WATRET AL, DE WIT KL, et al. The inflammatory response to cardiopulmonary bypass: Part 2 – Anti-inflammatory therapeutic strategies. J Cardiothorac Vasc Anesth 2009; 23: 384-93
- WHITLOCK RP, CHAN S, DEVEREAUX PI, et al. Clinical benefit of steroid use in patients undergoing cardiopulmonary bypass : A meta-analysis of randomized trials. Eur Heart J 2008 ; 29 : 2592-600
- WHITLOCK RP, DEVEREAUX PJ, TEOH KH, et al. Methylprednisolone in patients undergoing cardiopulmonary bypass (SIRS): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 26:1243-53
- ZANGRILLO A, GAROZZO FA, BIONDI-ZOCCAI G, et al. Miniaturized cardiopulmonary bypass improves short-term outcome in cardiac surgery: a meta-analysis of randomized controlled trials. J Thorac Cardiovasc Surg 2010; 139:1162-9
- ZHENG Z, JAYARAM R, JIANG L, et al. Perioperative rosuvastatin in cardiac surgery. N Engl J Med 2016; 374:1744-53